पाठ 13 में "" पाठ्यक्रम से " नौसिखियों के लिए रसायन विज्ञान»विचार करें कि रासायनिक समीकरणों की आवश्यकता क्यों है; आइए सीखें कि गुणांकों को सही ढंग से व्यवस्थित करके रासायनिक प्रतिक्रियाओं को कैसे बराबर किया जाए। इस पाठ के लिए आपको पिछले पाठों से बुनियादी रसायन शास्त्र जानने की आवश्यकता होगी। अनुभवजन्य सूत्रों और रासायनिक विश्लेषण पर गहराई से नज़र डालने के लिए मौलिक विश्लेषण के बारे में अवश्य पढ़ें।
ऑक्सीजन O2 में मीथेन CH4 के दहन की प्रतिक्रिया के परिणामस्वरूप, कार्बन डाइऑक्साइड CO2 और पानी H2O बनते हैं। इस प्रतिक्रिया का वर्णन किया जा सकता है रासायनिक समीकरण:
- सीएच 4 + ओ 2 → सीओ 2 + एच 2 ओ (1)
आइए रासायनिक समीकरण से केवल एक संकेत के अलावा और अधिक जानकारी निकालने का प्रयास करें उत्पाद और अभिकर्मकप्रतिक्रियाएं. रासायनिक समीकरण (1) अपूर्ण है और इसलिए यह इस बारे में कोई जानकारी नहीं देता है कि प्रति 1 सीएच 4 अणु में कितने ओ 2 अणुओं की खपत होती है और परिणामस्वरूप कितने सीओ 2 और एच 2 ओ अणु प्राप्त होते हैं। लेकिन यदि हम संगत आणविक सूत्रों के सामने संख्यात्मक गुणांक लिखते हैं, जो इंगित करते हैं कि प्रत्येक प्रकार के कितने अणु प्रतिक्रिया में भाग लेते हैं, तो हमें मिलता है पूर्ण रासायनिक समीकरणप्रतिक्रियाएं.
रासायनिक समीकरण (1) की संरचना को पूरा करने के लिए, आपको एक सरल नियम याद रखना होगा: समीकरण के बाएं और दाएं पक्षों में प्रत्येक प्रकार के परमाणुओं की समान संख्या होनी चाहिए, क्योंकि रासायनिक प्रतिक्रिया के दौरान कोई नया परमाणु नहीं होता है निर्मित और विद्यमान नष्ट नहीं होते। यह नियम द्रव्यमान के संरक्षण के नियम पर आधारित है, जिसकी चर्चा हमने अध्याय की शुरुआत में की थी।
एक साधारण रासायनिक समीकरण से पूर्ण समीकरण प्राप्त करने के लिए यह आवश्यक है। तो, आइए प्रतिक्रिया के वास्तविक समीकरण (1) पर आगे बढ़ें: रासायनिक समीकरण पर एक और नज़र डालें, बिल्कुल दाएं और बाएं तरफ परमाणुओं और अणुओं पर। यह देखना आसान है कि प्रतिक्रिया में तीन प्रकार के परमाणु शामिल होते हैं: कार्बन सी, हाइड्रोजन एच और ऑक्सीजन ओ। आइए रासायनिक समीकरण के दाएं और बाएं तरफ प्रत्येक प्रकार के परमाणुओं की संख्या की गणना करें और तुलना करें।

आइए कार्बन से शुरू करें। बाईं ओर, एक C परमाणु CH 4 अणु का हिस्सा है, और दाईं ओर, एक C परमाणु CO 2 का हिस्सा है। इस प्रकार, बायीं और दायीं ओर कार्बन परमाणुओं की संख्या समान है, इसलिए हम इसे अकेला छोड़ देते हैं। लेकिन स्पष्टता के लिए, आइए कार्बन वाले अणुओं के सामने 1 का गुणांक रखें, हालाँकि यह आवश्यक नहीं है:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
फिर हम हाइड्रोजन परमाणुओं एच की गिनती के लिए आगे बढ़ते हैं। बायीं ओर सीएच 4 अणु में 4 एच परमाणु हैं (मात्रात्मक अर्थ में, एच 4 = 4 एच) और दाईं ओर केवल 2 एच परमाणु हैं। एच 2 ओ अणु, जो रासायनिक समीकरण (2) के बाईं ओर से दो गुना कम है। आइए बराबरी करें! ऐसा करने के लिए, आइए H2O अणु के सामने 2 का गुणांक रखें। अब हमारे पास अभिकारकों और उत्पादों दोनों में हाइड्रोजन H के 4 अणु होंगे:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
कृपया ध्यान दें कि गुणांक 2, जिसे हमने हाइड्रोजन एच को बराबर करने के लिए पानी के अणु एच 2 ओ के सामने लिखा था, इसकी संरचना में शामिल सभी परमाणुओं से 2 गुना बढ़ जाता है, यानी 2 एच 2 ओ का मतलब 4 एच और 2 ओ है। ठीक है, ऐसा लगता है कि हमने इसे सुलझा लिया है, अब केवल रासायनिक समीकरण (3) में ऑक्सीजन परमाणुओं की संख्या की गणना और तुलना करना बाकी है। यह तुरंत आपकी नज़र में आ जाता है कि बाईं ओर दाईं ओर की तुलना में ठीक 2 गुना कम O परमाणु हैं। अब आप पहले से ही जानते हैं कि रासायनिक समीकरणों को स्वयं कैसे संतुलित किया जाए, इसलिए मैं तुरंत अंतिम परिणाम लिखूंगा:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O या CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
जैसा कि आप देख सकते हैं, रासायनिक प्रतिक्रियाओं को बराबर करना इतनी मुश्किल बात नहीं है, और यहां रसायन विज्ञान नहीं, बल्कि गणित महत्वपूर्ण है। समीकरण (4) कहा जाता है पूरा समीकरणरासायनिक प्रतिक्रिया, क्योंकि यह द्रव्यमान के संरक्षण के नियम का पालन करती है, अर्थात। प्रतिक्रिया में प्रवेश करने वाले प्रत्येक प्रकार के परमाणुओं की संख्या प्रतिक्रिया के पूरा होने पर इस प्रकार के परमाणुओं की संख्या से बिल्कुल मेल खाती है। इस संपूर्ण रासायनिक समीकरण के प्रत्येक पक्ष में 1 कार्बन परमाणु, 4 हाइड्रोजन परमाणु और 4 ऑक्सीजन परमाणु होते हैं। हालाँकि, यह कुछ महत्वपूर्ण बिंदुओं को समझने लायक है: एक रासायनिक प्रतिक्रिया व्यक्तिगत मध्यवर्ती चरणों का एक जटिल अनुक्रम है, और इसलिए, उदाहरण के लिए, समीकरण (4) की व्याख्या इस अर्थ में नहीं की जा सकती है कि 1 मीथेन अणु को एक साथ 2 ऑक्सीजन से टकराना होगा अणु. प्रतिक्रिया उत्पादों के निर्माण के दौरान होने वाली प्रक्रियाएँ बहुत अधिक जटिल होती हैं। दूसरा बिंदु: किसी प्रतिक्रिया का पूरा समीकरण हमें उसके आणविक तंत्र के बारे में कुछ नहीं बताता है, यानी उसके घटित होने के दौरान आणविक स्तर पर होने वाली घटनाओं के अनुक्रम के बारे में।
रासायनिक प्रतिक्रिया समीकरणों में गुणांक
सही ढंग से व्यवस्था कैसे करें इसका एक और स्पष्ट उदाहरण कठिनाइयाँरासायनिक प्रतिक्रिया समीकरणों में: ट्रिनिट्रोटोलुइन (टीएनटी) सी 7 एच 5 एन 3 ओ 6 ऑक्सीजन के साथ तीव्रता से जुड़कर एच 2 ओ, सीओ 2 और एन 2 बनाता है। आइए प्रतिक्रिया समीकरण लिखें जिसे हम बराबर करेंगे:
- सी 7 एच 5 एन 3 ओ 6 + ओ 2 → सीओ 2 + एच 2 ओ + एन 2 (5)
दो टीएनटी अणुओं के आधार पर संपूर्ण समीकरण बनाना आसान है, क्योंकि बाईं ओर विषम संख्या में हाइड्रोजन और नाइट्रोजन परमाणु होते हैं, और दाईं ओर सम संख्या होती है:
- 2सी 7 एच 5 एन 3 ओ 6 + ओ 2 → सीओ 2 + एच 2 ओ + एन 2 (6)
तब यह स्पष्ट है कि 14 कार्बन परमाणु, 10 हाइड्रोजन परमाणु और 6 नाइट्रोजन परमाणु को कार्बन डाइऑक्साइड के 14 अणुओं, पानी के 5 अणुओं और नाइट्रोजन के 3 अणुओं में बदलना होगा:
- 2सी 7 एच 5 एन 3 ओ 6 + ओ 2 → 14सीओ 2 + 5एच 2 ओ + 3एन 2 (7)
अब दोनों भागों में ऑक्सीजन को छोड़कर सभी परमाणुओं की संख्या समान है। समीकरण के दाईं ओर मौजूद 33 ऑक्सीजन परमाणुओं में से 12 को दो मूल टीएनटी अणुओं द्वारा आपूर्ति की जाती है, और शेष 21 को 10.5 ओ 2 अणुओं द्वारा आपूर्ति की जानी चाहिए। इस प्रकार पूरा रासायनिक समीकरण इस प्रकार दिखेगा:
- 2सी 7 एच 5 एन 3 ओ 6 + 10.5ओ 2 → 14सीओ 2 + 5एच 2 ओ + 3एन 2 (8)
आप दोनों पक्षों को 2 से गुणा कर सकते हैं और गैर-पूर्णांक गुणांक 10.5 से छुटकारा पा सकते हैं:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
लेकिन ऐसा करने की आवश्यकता नहीं है, क्योंकि समीकरण के सभी गुणांकों का पूर्णांक होना आवश्यक नहीं है। एक टीएनटी अणु पर आधारित समीकरण बनाना और भी सही होगा:
- सी 7 एच 5 एन 3 ओ 6 + 5.25ओ 2 → 7सीओ 2 + 2.5एच 2 ओ + 1.5एन 2 (10)
संपूर्ण रासायनिक समीकरण (9) में बहुत सारी जानकारी होती है। सबसे पहले, यह प्रारंभिक पदार्थों को इंगित करता है - अभिकर्मकों, और उत्पादोंप्रतिक्रियाएं. इसके अलावा, यह दर्शाता है कि प्रतिक्रिया के दौरान प्रत्येक प्रकार के सभी परमाणु व्यक्तिगत रूप से संरक्षित होते हैं। यदि हम समीकरण (9) के दोनों पक्षों को अवोगाद्रो की संख्या एन ए = 6.022 10 23 से गुणा करते हैं, तो हम बता सकते हैं कि टीएनटी के 4 मोल ओ 2 के 21 मोल के साथ प्रतिक्रिया करके 28 मोल सीओ 2, 10 मोल एच 2 ओ और 6 बनाते हैं। N 2 के मोल.
एक और तरकीब है. आवर्त सारणी का उपयोग करके, हम इन सभी पदार्थों के आणविक द्रव्यमान निर्धारित करते हैं:
- सी 7 एच 5 एन 3 ओ 6 = 227.13 ग्राम/मोल
- O2 = 31.999 ग्राम/मोल
- CO2 = 44.010 ग्राम/मोल
- H2O = 18.015 ग्राम/मोल
- एन2 = 28.013 ग्राम/मोल
अब समीकरण 9 यह भी इंगित करेगा कि 4 227.13 ग्राम = 908.52 ग्राम टीएनटी को प्रतिक्रिया को पूरा करने के लिए 21 31.999 ग्राम = 671.98 ग्राम ऑक्सीजन की आवश्यकता होती है और परिणामस्वरूप 28 44.010 ग्राम = 1232.3 ग्राम सीओ 2 बनता है, 10·18.015 ग्राम = 180.15 g H2O और 6·28.013 g = 168.08 g N2. आइये देखें कि इस प्रतिक्रिया में द्रव्यमान संरक्षण का नियम संतुष्ट होता है या नहीं:
| अभिकर्मकों | उत्पादों | |
| 908.52 ग्राम टीएनटी | 1232.3 ग्राम CO2 | |
| 671.98 ग्राम CO2 | 180.15 ग्राम H2O | |
| 168.08 ग्राम एन2 | ||
| कुल | 1580.5 ग्राम | 1580.5 ग्राम |
लेकिन जरूरी नहीं कि अलग-अलग अणुओं को रासायनिक प्रतिक्रिया में भाग लेना पड़े। उदाहरण के लिए, कैल्शियम क्लोराइड CaCl2 और कार्बन डाइऑक्साइड CO2 का जलीय घोल बनाने के लिए चूना पत्थर CaCO3 और हाइड्रोक्लोरिक एसिड HCl की प्रतिक्रिया:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
रासायनिक समीकरण (11) कैल्शियम कार्बोनेट CaCO 3 (चूना पत्थर) और हाइड्रोक्लोरिक एसिड HCl की प्रतिक्रिया का वर्णन करता है जिससे कैल्शियम क्लोराइड CaCl 2 और कार्बन डाइऑक्साइड CO 2 का जलीय घोल बनता है। यह समीकरण पूर्ण है, क्योंकि इसके बाएँ और दाएँ पक्षों में प्रत्येक प्रकार के परमाणुओं की संख्या समान है।
इस समीकरण का अर्थ है मैक्रोस्कोपिक (दाढ़) स्तरइस प्रकार है: प्रतिक्रिया को पूरा करने के लिए CaCO 3 के 1 मोल या 100.09 ग्राम को 2 मोल या 72.92 ग्राम HCl की आवश्यकता होती है, जिसके परिणामस्वरूप CaCl 2 (110.99 g/mol), CO 2 (44.01 g/mol) और H 2 का 1 मोल प्राप्त होता है। ओ (18.02 ग्राम/मोल)। इन संख्यात्मक आंकड़ों से यह सत्यापित करना आसान है कि द्रव्यमान संरक्षण का नियम इस प्रतिक्रिया में संतुष्ट है।
समीकरण (11) की व्याख्या सूक्ष्म (आण्विक) स्तरयह इतना स्पष्ट नहीं है, क्योंकि कैल्शियम कार्बोनेट एक नमक है, आणविक यौगिक नहीं, और इसलिए रासायनिक समीकरण (11) को इस अर्थ में नहीं समझा जा सकता है कि कैल्शियम कार्बोनेट CaCO 3 का 1 अणु HCl के 2 अणुओं के साथ प्रतिक्रिया करता है। इसके अलावा, समाधान में एचसीएल अणु आम तौर पर एच + और सीएल - आयनों में अलग हो जाता है (टूट जाता है)। इस प्रकार, आणविक स्तर पर इस प्रतिक्रिया में क्या होता है इसका अधिक सही विवरण समीकरण द्वारा दिया गया है:
- CaCO 3 (sol.) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
यहां, प्रत्येक प्रकार के कण की भौतिक अवस्था को कोष्ठक में संक्षेप में दर्शाया गया है ( टीवी- मुश्किल, एक्यू.- जलीय घोल में हाइड्रेटेड आयन, जी।- गैस, और।- तरल)।
समीकरण (12) से पता चलता है कि ठोस CaCO 3 दो हाइड्रेटेड H + आयनों के साथ प्रतिक्रिया करता है, जिससे सकारात्मक आयन Ca 2+, CO 2 और H 2 O बनते हैं। समीकरण (12), अन्य पूर्ण रासायनिक समीकरणों की तरह, इसका कोई विचार नहीं देता है। आण्विक तंत्र प्रतिक्रिया करता है और पदार्थों की मात्रा की गणना के लिए कम सुविधाजनक है, हालांकि, यह सूक्ष्म स्तर पर क्या हो रहा है इसका बेहतर विवरण देता है।
स्वयं समाधान के साथ एक उदाहरण पर काम करके रासायनिक समीकरण बनाने के अपने ज्ञान को सुदृढ़ करें:
मुझे पाठ 13 से आशा है" रासायनिक समीकरण लिखना"आपने अपने लिए कुछ नया सीखा। यदि आपके कोई प्रश्न हैं, तो उन्हें टिप्पणियों में लिखें।
कलन विधि
रासायनिक प्रतिक्रिया समीकरणों में गुणांकों की व्यवस्था
रसायन विज्ञान शिक्षक एमबीओयू माध्यमिक विद्यालय क्रमांक 2
वोलोडचेंको स्वेतलाना निकोलायेवना
Ussuriysk
रासायनिक प्रतिक्रियाओं के समीकरणों में गुणांक की व्यवस्था
समीकरण के बाईं ओर एक तत्व के परमाणुओं की संख्या समीकरण के दाईं ओर उस तत्व के परमाणुओं की संख्या के बराबर होनी चाहिए।
कार्य 1 (समूहों के लिए)।प्रतिक्रिया में भाग लेने वाले प्रत्येक रासायनिक तत्व के परमाणुओं की संख्या निर्धारित करें।
1. परमाणुओं की संख्या की गणना करें:
ए) हाइड्रोजन: 8NH3, NaOH, 6NaOH, 2NaOH,एनजेडआरओ4, 2H2SO4, 3H2S04, 8H2SO4;
6) ऑक्सीजन: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03।
2. परमाणुओं की संख्या की गणना करें: ए)हाइड्रोजन:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
बी) ऑक्सीजन:
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
रासायनिक प्रतिक्रिया समीकरणों में गुणांकों की व्यवस्था के लिए एल्गोरिदम
А1 + О2→ А12О3A1-1 परमाणु A1-2
O-2 परमाणु O-3
2. आरेख के बाएँ और दाएँ भागों में अलग-अलग संख्या में परमाणुओं वाले तत्वों में से, उसे चुनें जिसके परमाणुओं की संख्या अधिक है
बायीं ओर O-2 परमाणु
दाहिनी ओर O-3 परमाणु
3. समीकरण के बायीं ओर इस तत्व के परमाणुओं की संख्या का लघुत्तम समापवर्तक (LCM) तथा दाहिनी ओर इस तत्व के परमाणुओं की संख्या ज्ञात करें।
एलसीएम = 6
4. समीकरण के बाईं ओर इस तत्व के परमाणुओं की संख्या से एलसीएम को विभाजित करें, समीकरण के बाईं ओर के लिए गुणांक प्राप्त करें
6:2 = 3
अल + ZO 2 →अल 2 के बारे में 3
5. एलसीएम को समीकरण के दाईं ओर इस तत्व के परमाणुओं की संख्या से विभाजित करें, समीकरण के दाईं ओर के लिए गुणांक प्राप्त करें
6:3 = 2
ए1+ ओ 2 →2A1 2 ओ 3
6. यदि निर्धारित गुणांक ने किसी अन्य तत्व के परमाणुओं की संख्या बदल दी है, तो चरण 3, 4, 5 दोबारा दोहराएं।
A1 + ZO 2 → →2ए1 2 के बारे में 3
A1 -1 परमाणु A1 - 4
एलसीएम = 4
4:1=4 4:4=1
4ए1 + जेडओ 2 → →2A1 2 के बारे में 3
. ज्ञान अर्जन की प्राथमिक परीक्षा (8-10 मिनट) .).
आरेख के बाईं ओर दो ऑक्सीजन परमाणु हैं, और दाईं ओर एक है। गुणांकों का उपयोग करके परमाणुओं की संख्या को बराबर किया जाना चाहिए।
1)2एमजी+ओ2 →2एमजीओ
2) सीएसीओ3 + 2HCl→CaCl2 + एन2 ओ + सीओ2
कार्य 2 गुणांकों को रासायनिक प्रतिक्रियाओं के समीकरणों में रखें (ध्यान दें कि गुणांक केवल एक तत्व के परमाणुओं की संख्या को बदलता है):
1. फ़े 2 हे 3 + ए एल → ए एल 2 के बारे में 3 + फे; एमजी+एन 2 → मिलीग्राम 3 एन 2 ;
2. अल + एस → अल 2 एस 3 ; ए1+ साथ → अल 4 सी 3 ;
3. अल + सीआर 2 हे 3 → सीआर+अल 2 हे 3 ; सीए+पी → सीए 3 पी 2 ;
4. सी+ एच 2 → चौधरी 4 ; सीए + सी → एसएएस 2 ;
5. Fe + O 2 → फ़े 3 हे 4 ; सी + एमजी → मिलीग्राम 2 सी;
6/.Na+S → ना 2 एस; CaO+ साथ → सीएसी 2 + सीओ;
7.Ca+N 2 → सी ए 3 एन 2 ; सी+सीएल 2 → SiCl 4 ;
8. एजी+एस → एजी 2 एस; एन 2 + साथ एल 2 → एन एस एल;
9.एन 2 + ओ 2 → नहीं; सीओ 2 + साथ → सीओ ;
10. नमस्ते → एन 2 → + 1 2 ; एमजी+ एन एस एल → एमजीसीएल 2 + एन 2 ;
11.FeS+ एन एस 1 → FeCl 2 +एच 2 एस; Zn+HCl → ZnCl 2 +एच 2 ;
12. ब्र 2 +की → केबीआर+आई 2 ; सी+एचएफ (आर) → सीआईएफ 4 +एच 2 ;
1./ एचसीएल+ना 2 सीओ 3 → सीओ 2 +एच 2 ओ+ NaCl; केसीएलओ 3 +एस → → केसीएल+एसओ 2 ;
14. सीएल 2 + केबीआर → केसीएल + ब्र 2 ; SiO 2 + साथ → सी + सीओ;
15. SiO 2 + साथ → सीआईसी + सीओ; एमजी + SiO 2 → मिलीग्राम 2 सी + एमजीओ
16. मिलीग्राम 2 सी + एचसीएल → एमजीसीएल 2 + SiH 4
1.रासायनिक प्रतिक्रिया का समीकरण क्या है?
2.समीकरण के दाईं ओर क्या लिखा है? और बाईं ओर?
3.किसी समीकरण में "+" चिह्न का क्या अर्थ है?
4. गुणांकों को रासायनिक समीकरणों में क्यों रखा जाता है?
रेडॉक्स प्रतिक्रियाओं के समीकरणों में गुणांक निर्धारित करने की कई विधियाँ हैं। हम इलेक्ट्रॉनिक संतुलन विधि का उपयोग करते हैं, जिसमें संपूर्ण ओवीआर समीकरण का संकलन निम्नलिखित क्रम में किया जाता है:
1. एक प्रतिक्रिया आरेख बनाएं, जिसमें प्रतिक्रिया करने वाले पदार्थों और प्रतिक्रिया के परिणामस्वरूप उत्पन्न होने वाले पदार्थों को दर्शाया जाए, उदाहरण के लिए:
2. परमाणुओं की ऑक्सीकरण अवस्था ज्ञात करें तथा जिन तत्वों की ऑक्सीकरण अवस्था परिवर्तित हो गई है, उन्हें नोट करते हुए तत्वों के प्रतीकों के ऊपर उसका चिह्न एवं मान लिखें:
3. ऑक्सीकरण और कमी प्रतिक्रियाओं के लिए इलेक्ट्रॉनिक समीकरण लिखें, कम करने वाले एजेंट द्वारा दान किए गए और ऑक्सीकरण एजेंट द्वारा स्वीकार किए गए इलेक्ट्रॉनों की संख्या निर्धारित करें, और फिर उचित गुणांक द्वारा गुणा करके उन्हें बराबर करें:
4. इलेक्ट्रॉनिक संतुलन के अनुरूप प्राप्त गुणांकों को मुख्य समीकरण में स्थानांतरित किया जाता है:
5. उन परमाणुओं और आयनों की संख्या को बराबर करें जो ऑक्सीकरण अवस्था को नहीं बदलते हैं (क्रम में: धातु, अधातु, हाइड्रोजन):
6. प्रतिक्रिया समीकरण के बाएँ और दाएँ पक्षों पर ऑक्सीजन परमाणुओं की संख्या के आधार पर गुणांकों के चयन की शुद्धता की जाँच करें - वे बराबर होने चाहिए (इस समीकरण में 24 = 18 + 2 + 4, 24 = 24)।
आइए एक अधिक जटिल उदाहरण देखें:
आइए हम अणुओं में परमाणुओं की ऑक्सीकरण अवस्थाएँ निर्धारित करें:
आइए ऑक्सीकरण और कमी प्रतिक्रियाओं के लिए इलेक्ट्रॉनिक समीकरण बनाएं और दिए गए और स्वीकृत इलेक्ट्रॉनों की संख्या को बराबर करें:
आइए गुणांकों को मुख्य समीकरण में स्थानांतरित करें:
आइए उन परमाणुओं की संख्या को बराबर करें जो ऑक्सीकरण अवस्था को नहीं बदलते हैं:
समीकरण के दाएं और बाएं तरफ ऑक्सीजन परमाणुओं की संख्या की गणना करके, हम यह सुनिश्चित करेंगे कि गुणांक सही ढंग से चुने गए हैं।
सबसे महत्वपूर्ण ऑक्सीकरण और कम करने वाले एजेंट
तत्वों के रेडॉक्स गुण परमाणुओं के इलेक्ट्रॉनिक खोल की संरचना पर निर्भर करते हैं और मेंडेलीव की आवर्त सारणी में उनकी स्थिति से निर्धारित होते हैं।
धातुएँ, जिनके बाहरी ऊर्जा स्तर पर 1-3 इलेक्ट्रॉन होते हैं, आसानी से उन्हें छोड़ देते हैं और केवल कम करने वाले गुण प्रदर्शित करते हैं। अधातुएँ (समूह IV-VII के तत्व) इलेक्ट्रॉन दान और स्वीकार दोनों कर सकते हैं, इसलिए वे अपचायक और ऑक्सीकरण दोनों गुण प्रदर्शित कर सकते हैं। किसी तत्व की परमाणु संख्या में वृद्धि के साथ अवधि में, सरल पदार्थों के अपचायक गुण कमजोर हो जाते हैं, और ऑक्सीकरण गुण बढ़ जाते हैं। क्रमिक संख्या में वृद्धि वाले समूहों में, कम करने वाले गुण बढ़ जाते हैं, और ऑक्सीकरण गुण कमजोर हो जाते हैं। इस प्रकार, सरल पदार्थों में, सबसे अच्छे कम करने वाले एजेंट क्षार धातु, एल्यूमीनियम, हाइड्रोजन, कार्बन हैं; सर्वोत्तम ऑक्सीकरण एजेंट हैलोजन और ऑक्सीजन हैं.
जटिल पदार्थों के रेडॉक्स गुण उन्हें बनाने वाले परमाणुओं के ऑक्सीकरण की डिग्री पर निर्भर करते हैं। सबसे कम ऑक्सीकरण अवस्था वाले परमाणुओं वाले पदार्थ कम करने वाले गुण प्रदर्शित करते हैं. सबसे महत्वपूर्ण कम करने वाले एजेंट कार्बन मोनोऑक्साइड हैं  , हाइड्रोजन सल्फाइड
, हाइड्रोजन सल्फाइड  , आयरन (II) सल्फेट
, आयरन (II) सल्फेट  .उच्चतम ऑक्सीकरण अवस्था वाले परमाणुओं वाले पदार्थ ऑक्सीकरण गुण प्रदर्शित करते हैं. सबसे महत्वपूर्ण ऑक्सीकरण एजेंट पोटेशियम परमैंगनेट हैं
.उच्चतम ऑक्सीकरण अवस्था वाले परमाणुओं वाले पदार्थ ऑक्सीकरण गुण प्रदर्शित करते हैं. सबसे महत्वपूर्ण ऑक्सीकरण एजेंट पोटेशियम परमैंगनेट हैं  , पोटेशियम डाइक्रोमेट
, पोटेशियम डाइक्रोमेट  , हाइड्रोजन पेरोक्साइड
, हाइड्रोजन पेरोक्साइड  , नाइट्रिक एसिड
, नाइट्रिक एसिड  , सांद्र सल्फ्यूरिक एसिड
, सांद्र सल्फ्यूरिक एसिड  .
.
मध्यवर्ती ऑक्सीकरण अवस्था वाले परमाणुओं वाले पदार्थ ऑक्सीकरण या कम करने वाले एजेंटों के रूप में व्यवहार कर सकते हैंउन पदार्थों के गुणों पर निर्भर करता है जिनके साथ वे बातचीत करते हैं और प्रतिक्रिया की स्थिति। तो प्रतिक्रिया में  सल्फ्यूरस एसिड कम करने वाले गुण प्रदर्शित करता है:
सल्फ्यूरस एसिड कम करने वाले गुण प्रदर्शित करता है:
और हाइड्रोजन सल्फाइड के साथ परस्पर क्रिया करते समय यह एक ऑक्सीकरण एजेंट होता है:

इसके अलावा, ऐसे पदार्थों के लिए, स्व-ऑक्सीकरण-स्व-कमी प्रतिक्रियाएं संभव हैं, जो एक ही तत्व के परमाणुओं की ऑक्सीकरण अवस्था में एक साथ वृद्धि और कमी के साथ होती हैं, उदाहरण के लिए:
कई ऑक्सीकरण और कम करने वाले एजेंटों की ताकत माध्यम के पीएच पर निर्भर करती है। उदाहरण के लिए, 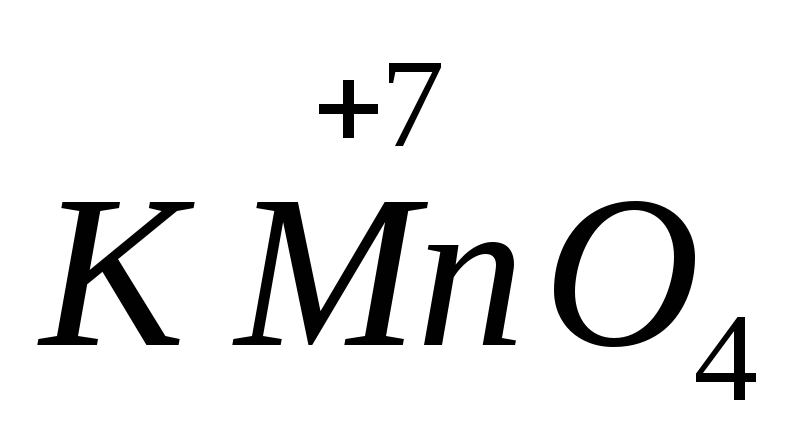 क्षारीय वातावरण में यह कम हो जाता है
क्षारीय वातावरण में यह कम हो जाता है  , तटस्थ में
, तटस्थ में  , सल्फ्यूरिक एसिड की उपस्थिति में - तक
, सल्फ्यूरिक एसिड की उपस्थिति में - तक  .
.
एल  क्या रासायनिक समीकरणों में गुणांकों को रखना आसान है?
क्या रासायनिक समीकरणों में गुणांकों को रखना आसान है?
इसलिए मेरे बच्चे रसायन विज्ञान में बड़े हो गए हैं (मैं 8वीं "बी" कक्षा में कक्षा शिक्षक हूं)। रसायन विज्ञान अक्सर बच्चों को पहले पाठ में पढ़ाया जाता है, लेकिन गुरुवार को मेरे पास पहला पाठ नहीं था, और मैंने "बच्चों को देखने" के लिए वेलेंटीना इवानोव्ना के पाठ में जाने और डायरियाँ जाँचने के लिए कहा। इस विषय ने मुझे आकर्षित किया; स्कूल में मुझे रसायन विज्ञान पसंद था, और मैंने डायरियाँ नहीं देखीं। एक बार फिर, मुझे विश्वास हो गया कि छात्रों को अक्सर इस तथ्य के कारण कठिनाइयों का अनुभव होता है कि वे अंतःविषय संबंध नहीं देखते हैं। रसायन विज्ञान के इस पाठ में, छात्रों को रसायनों की संयोजकता के आधार पर रासायनिक समीकरण बनाने की आवश्यकता थी। और कई विद्यार्थियों को संख्यात्मक गुणांक निर्धारित करने में कठिनाई हुई। वेलेंटीना इवानोव्ना और मेरी रसायन विज्ञान की अगली कक्षा शनिवार को एक साथ थी।
अभ्यास 1।
निम्नलिखित वाक्यों को रासायनिक समीकरण के रूप में लिखिए:
ए) "जब कैल्शियम कार्बोनेट को जलाया जाता है, तो कैल्शियम ऑक्साइड और कार्बन मोनोऑक्साइड (IV) बनते हैं"; बी) "जब फॉस्फोरस (वी) ऑक्साइड पानी के साथ प्रतिक्रिया करता है, तो फॉस्फोरिक एसिड प्राप्त होता है।"
समाधान:
ए) CaCO 3 = CaO + CO 2 - प्रतिक्रिया एंडोथर्मिक है। इस कार्य में कोई कठिनाई नहीं हुई, क्योंकि संख्यात्मक गुणांकों की तलाश करने की कोई आवश्यकता नहीं थी। प्रारंभ में, समीकरण के बाएँ और दाएँ पक्षों में एक कैल्शियम परमाणु, एक कार्बन परमाणु और तीन ऑक्सीजन परमाणु होते हैं।
बी) पी 2 ओ 5 + 3एच 2 ओ = 2एच 3 पीओ 4 - प्रतिक्रिया ऊष्माक्षेपी है। दूसरे समीकरण में समस्याएँ थीं; संख्यात्मक गुणांकों के बिना, सही समानता काम नहीं करती थी: P 2 O 5 + H 2 O → H 3 PO 4। जाहिर है, एक सही समानता तैयार करने के लिए, आपको संख्यात्मक गुणांक का चयन करना होगा। यदि आप चुनते हैं, तो आप फॉस्फोरस से शुरू कर सकते हैं: बाईं ओर दो परमाणु हैं, और दाईं ओर एक है, इसलिए नाइट्रिक एसिड के सूत्र से पहले हम दो के बराबर एक संख्यात्मक कारक डालते हैं और फिर हमें मिलता है: पी 2 ओ 5 + एच 2 ओ → 2एच 3 पीओ 4। लेकिन अब यह ऑक्सीजन और हाइड्रोजन परमाणुओं की संख्या को बराबर करने के लिए बना हुआ है: बाईं ओर दो हाइड्रोजन परमाणु हैं, और दाईं ओर छह परमाणु हैं, इसलिए पानी के सूत्र से पहले हम तीन के बराबर एक संख्यात्मक गुणांक डालते हैं और फिर हमें मिलता है: पी 2 ओ 5 + 3एच 2 ओ → 2एच 3 पीओ 4। अब यह सत्यापित करना आसान है कि समीकरण के प्रत्येक भाग में फॉस्फोरस परमाणु, हाइड्रोजन परमाणु और ऑक्सीजन परमाणु समान मात्रा में हैं, इसलिए, हमने रासायनिक प्रतिक्रिया का सही समीकरण प्राप्त किया है: पी 2 ओ 5 + 3 एच 2 ओ = 2 एच 3 पीओ 4.
दूसरा तरीका: बीजीय.मान लीजिए कि हमने समीकरण में तीन गुणांक रखे हैं ए, बी, सी , कि रासायनिक प्रतिक्रिया का सही समीकरण प्राप्त किया गया था: ए P2O5+ वी H2O= साथ H3PO4. चूँकि समीकरण तीन प्रकार के परमाणुओं का उपयोग करता है, हम तीन अज्ञात के साथ तीन रैखिक समीकरणों की एक प्रणाली बनाएंगे एसीऔर साथ .
वे पदार्थ जो रासायनिक प्रतिक्रिया में उपयोग किए गए थे: पी - फॉस्फोरस; ओ 2 – ऑक्सीजन; पी 2 ओ 5 - फॉस्फोरस (वी) ऑक्साइड।
बी) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4।
रासायनिक प्रतिक्रिया में उपयोग किए जाने वाले पदार्थ: Fe 2 (SO 4) 3 - आयरन (III) सल्फेट; KOH - पोटेशियम हाइड्रॉक्साइड; Fe(OH) 3 - आयरन (III) हाइड्रॉक्साइड; के 2 एसओ 4 - पोटेशियम सल्फेट।
डी) CuOH → Cu 2 O + H 2 O।
समाधान: 2CuOH = Cu 2 O + H 2 O. संख्यात्मक गुणांक निर्धारित करने की समस्या को समीकरणों की एक प्रणाली बनाकर हल किया गया था: 
वे पदार्थ जो रासायनिक प्रतिक्रिया में उपयोग किए गए थे: CuOH - कॉपर (I) हाइड्रॉक्साइड; Cu 2 O - कॉपर (I) ऑक्साइड; एच 2 ओ - पानी।
डी) सीएस 2 + ओ 2 → सीओ 2 + एसओ 2।
समाधान: सीएस 2 + 3ओ 2 = सीओ 2 + 2एसओ 2। हमने गुणांकों का चयन करके हल किया: हमने सल्फर परमाणुओं की संख्या को बराबर किया (2); ऑक्सीजन परमाणुओं की संख्या बराबर हो गई (3)।
पदार्थ जो रासायनिक प्रतिक्रिया में उपयोग किए गए थे: सीएस 2 - सल्फर (IV) सल्फाइड; ओ 2-
वे पदार्थ जो रासायनिक प्रतिक्रिया में उपयोग किए गए थे: FeS 2 - पाइराइट; ओ 2 – ऑक्सीजन; Fe 2 O 3 - आयरन (III) ऑक्साइड; एसओ 2 - सल्फर ऑक्साइड (IV)।
व्यायाम 3.
(इसे एक अलग कार्य के रूप में समाधान के लिए प्रस्तावित किया गया था)।
स्थिति:
निम्नलिखित योजनाओं के अनुसार रासायनिक प्रतिक्रियाओं के समीकरण लिखिए:
ए) फॉस्फोरिक एसिड + सोडियम हाइड्रॉक्साइड → सोडियम फॉस्फेट + पानी;
बी) सोडियम ऑक्साइड + पानी → सोडियम हाइड्रॉक्साइड;
बी) आयरन (II) ऑक्साइड + एल्युमिनियम → एल्युमीनियम ऑक्साइड + आयरन;
डी) कॉपर (II) हाइड्रॉक्साइड → कॉपर (II) ऑक्साइड + पानी।
उत्तर:
ए) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
बी) Na 2 O + H 2 O = 2NaOH;
बी) 3FeO + 2Al = Al 2 O 3 + 3Fe;
डी) Cu(OH) 2 = CuO + H 2 O.
10 मिनट में, 85% छात्रों ने कार्य "उत्कृष्टतापूर्वक" पूरा किया, जिससे वेलेंटीना इवानोव्ना को सुखद आश्चर्य हुआ।
सबसे सरल प्रतिक्रिया समीकरण है:
Fe + S => FeS
आपको न केवल प्रतिक्रिया समीकरण लिखने में सक्षम होना चाहिए, बल्कि उसे पढ़ने में भी सक्षम होना चाहिए। यह समीकरण, अपने सरलतम रूप में, इस प्रकार पढ़ता है: एक लौह अणु एक सल्फर अणु के साथ परस्पर क्रिया करता है, जिसके परिणामस्वरूप लौह सल्फाइड का एक अणु बनता है।
प्रतिक्रिया समीकरण लिखने में सबसे कठिन काम प्रतिक्रिया उत्पादों के लिए सूत्र बनाना है, अर्थात। निर्मित पदार्थ. यहां केवल एक ही नियम है: अणुओं के सूत्र उनके घटक तत्वों की संयोजकता के अनुसार सख्ती से बनाए जाते हैं।
इसके अलावा, प्रतिक्रिया समीकरण बनाते समय, किसी को पदार्थों के द्रव्यमान के संरक्षण के नियम को याद रखना चाहिए: प्रारंभिक पदार्थों के अणुओं के सभी परमाणुओं को प्रतिक्रिया उत्पादों के अणुओं में शामिल किया जाना चाहिए। एक भी परमाणु गायब नहीं होना चाहिए या अप्रत्याशित रूप से प्रकट नहीं होना चाहिए। इसलिए, कभी-कभी, प्रतिक्रिया समीकरण में सभी सूत्र लिखने के बाद, आपको समीकरण के प्रत्येक भाग में परमाणुओं की संख्या को बराबर करना होगा - गुणांक निर्धारित करना होगा। यहाँ एक उदाहरण है:
सी + ओ 2 => सीओ 2यहां, प्रत्येक तत्व के समीकरण के दाएं और बाएं दोनों तरफ परमाणुओं की संख्या समान है। समीकरण तैयार है.
Cu+O 2 => CuO
और यहां समीकरण के बाईं ओर दाईं ओर की तुलना में अधिक ऑक्सीजन परमाणु हैं। कॉपर ऑक्साइड के इतने सारे अणु प्राप्त करना आवश्यक है
CuO , ताकि उनमें ऑक्सीजन परमाणुओं की संख्या समान हो, यानी 2। इसलिए, सूत्रCuO गुणांक 2 सेट करें:Cu+O2 => 2 CuO
अब तांबे के परमाणुओं की संख्या समान नहीं है। समीकरण के बाईं ओर, तांबे के चिह्न से पहले हम गुणांक 2 डालते हैं:
2 Cu + O2 => 2 CuO
गणना करें कि समीकरण के बायीं और दायीं ओर प्रत्येक तत्व के परमाणुओं की संख्या समान है या नहीं। यदि हाँ, तो प्रतिक्रिया समीकरण सही है.
एक और उदाहरण: अल+ओ 2 = अल 2 हे 3
और यहां प्रतिक्रिया से पहले और बाद में प्रत्येक तत्व के परमाणुओं की अलग-अलग संख्या होती है। हम गैस से समतल करना शुरू करते हैं - ऑक्सीजन अणुओं के साथ:
1 बाकी 2 ऑक्सीजन परमाणु, और दाईं ओर 3 हैं। हम इन दोनों संख्याओं के लघुत्तम समापवर्त्य की तलाश कर रहे हैं। यह सबसे छोटी संख्या है जो 2 और 3, यानी 6 दोनों से विभाज्य है। ऑक्सीजन और एल्यूमीनियम ऑक्साइड के फार्मूले से पहलेअल 2 हे 3 हम ऐसे गुणांक निर्धारित करते हैं ताकि इन अणुओं में ऑक्सीजन परमाणुओं की कुल संख्या 6 हो:
अल+ 3 ओ 2= 2 अल 2 ओ 3
2) हम एल्यूमीनियम परमाणुओं की संख्या गिनते हैं: बाईं ओर 1 परमाणु है, और दाईं ओर दो अणुओं में 2 परमाणु हैं, यानी 4। समीकरण के बाईं ओर एल्यूमीनियम चिह्न से पहले हम गुणांक 4 डालते हैं:
4Al + 3O 2 => 2 Al2O3
3) एक बार फिर हम प्रतिक्रिया से पहले और बाद के सभी परमाणुओं की गिनती करते हैं: प्रत्येक में 4 एल्यूमीनियम परमाणु और 6 ऑक्सीजन परमाणु।
सब कुछ क्रम में है, प्रतिक्रिया समीकरण सही है. और यदि प्रतिक्रिया गर्म होने पर होती है, तो तीर के ऊपर एक अतिरिक्त चिन्ह लगाया जाता हैटी।
रासायनिक प्रतिक्रिया का समीकरण रासायनिक सूत्रों और गुणांकों का उपयोग करके रासायनिक प्रतिक्रिया की प्रगति की रिकॉर्डिंग है।






