पाठ के दौरान, आप समावयवता के प्रकारों का एक सामान्य विचार प्राप्त करेंगे और सीखेंगे कि समावयवी क्या है। कार्बनिक रसायन विज्ञान में आइसोमेरिज्म के प्रकारों के बारे में जानें: संरचनात्मक और स्थानिक (स्टीरियोइसोमेरिज्म)। पदार्थों के संरचनात्मक सूत्रों का उपयोग करते हुए, संरचनात्मक समावयवता (कंकाल और स्थितीय समावयवता) के उपप्रकारों पर विचार करें, स्थानिक समावयवता के प्रकारों के बारे में जानें: ज्यामितीय और ऑप्टिकल।
विषय: कार्बनिक रसायन विज्ञान का परिचय
पाठ: समावयवता. समरूपता के प्रकार. संरचनात्मक समरूपता, ज्यामितीय, ऑप्टिकल
कार्बनिक पदार्थों का वर्णन करने वाले सूत्रों के प्रकार जिनकी हमने पहले जांच की थी, यह दर्शाता है कि कई अलग-अलग संरचनात्मक सूत्र एक आणविक सूत्र के अनुरूप हो सकते हैं।
उदाहरण के लिए, आणविक सूत्र सी 2एच 6हेअनुरूप दो पदार्थविभिन्न संरचनात्मक सूत्रों के साथ - एथिल अल्कोहल और डाइमिथाइल ईथर। चावल। 1.
एथिल अल्कोहल, एक तरल जो धातु सोडियम के साथ प्रतिक्रिया करके हाइड्रोजन छोड़ता है, +78.5 0 C पर उबलता है। समान परिस्थितियों में, डाइमिथाइल ईथर, एक गैस जो सोडियम के साथ प्रतिक्रिया नहीं करती है, -23 0 C पर उबलती है।
ये पदार्थ अपनी संरचना में भिन्न होते हैं - विभिन्न पदार्थों का आणविक सूत्र समान होता है।
चावल। 1. अंतरवर्गीय समावयवता
ऐसे पदार्थों के अस्तित्व की घटना जिनकी संरचना समान है, लेकिन अलग-अलग संरचनाएं हैं और इसलिए अलग-अलग गुण हैं, आइसोमेरिज्म कहलाते हैं (ग्रीक शब्द "आइसोस" से - "बराबर" और "मेरोस" - "भाग", "शेयर")।
समरूपता के प्रकार
अस्तित्व अलग - अलग प्रकारसमरूपता.
संरचनात्मक समावयवता एक अणु में परमाणुओं के जुड़ने के एक अलग क्रम से जुड़ी होती है।
इथेनॉल और डाइमिथाइल ईथर संरचनात्मक आइसोमर्स हैं। चूँकि वे कार्बनिक यौगिकों के विभिन्न वर्गों से संबंधित हैं, इसलिए इस प्रकार की संरचनात्मक समावयवता कहलाती है इंटरक्लास भी . चावल। 1.
संरचनात्मक आइसोमर्स भी यौगिकों के एक ही वर्ग में मौजूद हो सकते हैं, उदाहरण के लिए, सूत्र सी 5 एच 12 तीन अलग-अलग हाइड्रोकार्बन से मेल खाता है। यह कार्बन कंकाल समरूपता. चावल। 2.

चावल। 2 पदार्थों के उदाहरण - संरचनात्मक आइसोमर्स
समान कार्बन कंकाल वाले संरचनात्मक आइसोमर्स होते हैं, जो हाइड्रोजन की जगह लेने वाले कई बांडों (डबल और ट्रिपल) या परमाणुओं की स्थिति में भिन्न होते हैं। इस प्रकार की संरचनात्मक समावयवता कहलाती है स्थितीय समरूपता.
चावल। 3. संरचनात्मक स्थिति समरूपता
केवल एकल बांड वाले अणुओं में, कमरे के तापमान पर बांड के चारों ओर आणविक टुकड़ों का लगभग मुक्त घूमना संभव है, और, उदाहरण के लिए, 1,2-डाइक्लोरोइथेन के सूत्रों की सभी छवियां समतुल्य हैं। चावल। 4

चावल। 4. एकल आबंध के चारों ओर क्लोरीन परमाणुओं की स्थिति
यदि घूर्णन में बाधा आती है, उदाहरण के लिए, चक्रीय अणु में या दोहरे बंधन के साथ, तो ज्यामितीय या सीआईएस-ट्रांस आइसोमेरिज्म।सीआईएस-आइसोमर्स में, प्रतिस्थापन रिंग या डबल बॉन्ड के विमान के एक तरफ स्थित होते हैं, ट्रांस-आइसोमर्स में - विपरीत पक्षों पर।
सीआईएस-ट्रांस आइसोमर्स तब मौजूद होते हैं जब वे कार्बन परमाणु से बंधे होते हैं। दो अलगउप चावल। 5.



चावल। 5. सीआईएस और ट्रांस आइसोमर्स
एक अन्य प्रकार की समावयवता इस तथ्य के कारण उत्पन्न होती है कि चार एकल बंधों वाला एक कार्बन परमाणु अपने प्रतिस्थापनों के साथ एक स्थानिक संरचना बनाता है - एक टेट्राहेड्रोन। यदि एक अणु में कम से कम एक कार्बन परमाणु चार अलग-अलग प्रतिस्थापनों से बंधा हुआ है, ऑप्टिकल समरूपता. ऐसे अणु अपनी दर्पण छवि से मेल नहीं खाते। इस संपत्ति को ग्रीक से चिरैलिटी कहा जाता है साथयहाँ- "हाथ"। चावल। 6. ऑप्टिकल आइसोमेरिज्म कई अणुओं की विशेषता है जो जीवित जीवों को बनाते हैं।
|
|
|
चावल। 6. ऑप्टिकल आइसोमर्स के उदाहरण
ऑप्टिकल आइसोमेरिज्म भी कहा जाता है enantiomerism (ग्रीक से enantios- "विपरीत" और मेरोस- "भाग"), और ऑप्टिकल आइसोमर्स - एनंटीओमर . एनैन्टीओमर्स वैकल्पिक रूप से सक्रिय हैं; वे प्रकाश के ध्रुवीकरण के तल को एक ही कोण से घुमाते हैं, लेकिन विपरीत दिशाओं में: डी- , या (+)-आइसोमर, - दाईं ओर, एल , या (-)-आइसोमर, - बाईं ओर। एनैन्टीओमर्स की समान मात्रा का मिश्रण कहलाता है रेसमेट, वैकल्पिक रूप से निष्क्रिय है और प्रतीक द्वारा दर्शाया गया है डी,एल- या (±).
पाठ का सारांश
पाठ के दौरान, आपको समावयवता के प्रकार और समावयवी क्या है, इसकी सामान्य समझ प्राप्त हुई। हमने कार्बनिक रसायन विज्ञान में आइसोमेरिज्म के प्रकारों के बारे में सीखा: संरचनात्मक और स्थानिक (स्टीरियोइसोमेरिज्म)। पदार्थों के संरचनात्मक सूत्रों का उपयोग करते हुए, हमने संरचनात्मक समरूपता (कंकाल और स्थितीय समरूपता) के उपप्रकारों की जांच की, और स्थानिक समरूपता के प्रकारों से परिचित हुए: ज्यामितीय और ऑप्टिकल।
ग्रन्थसूची
1. रुडज़ाइटिस जी.ई. रसायन विज्ञान। सामान्य रसायन विज्ञान के मूल सिद्धांत. 10वीं कक्षा: सामान्य शिक्षा संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन. - 14वाँ संस्करण। - एम.: शिक्षा, 2012।
2. रसायन शास्त्र. ग्रेड 10। प्रोफ़ाइल स्तर: शैक्षणिक. सामान्य शिक्षा के लिए संस्थान/ वी.वी. एरेमिन, एन.ई. कुज़्मेंको, वी.वी. लुनिन एट अल। - एम.: बस्टर्ड, 2008. - 463 पी।
3. रसायन शास्त्र. ग्रेड 11। प्रोफ़ाइल स्तर: शैक्षणिक. सामान्य शिक्षा के लिए संस्थान/ वी.वी. एरेमिन, एन.ई. कुज़्मेंको, वी.वी. लुनिन एट अल। - एम.: बस्टर्ड, 2010. - 462 पी।
4. खोमचेंको जी.पी., खोमचेंको आई.जी. विश्वविद्यालयों में प्रवेश करने वालों के लिए रसायन विज्ञान में समस्याओं का संग्रह। - चौथा संस्करण। - एम.: आरआईए "न्यू वेव": प्रकाशक उमेरेनकोव, 2012. - 278 पी।
गृहकार्य
1. संख्या 1,2 (पृ.39) रुडज़ाइटिस जी.ई. रसायन विज्ञान। सामान्य रसायन विज्ञान के मूल सिद्धांत. 10वीं कक्षा: सामान्य शिक्षा संस्थानों के लिए पाठ्यपुस्तक: बुनियादी स्तर / जी.ई. रुडज़ाइटिस, एफ.जी. फेल्डमैन. - 14वाँ संस्करण। - एम.: शिक्षा, 2012।
2. एथिलीन श्रृंखला के हाइड्रोकार्बन में आइसोमर्स की संख्या संतृप्त हाइड्रोकार्बन की तुलना में अधिक क्यों होती है?
3. किस हाइड्रोकार्बन में स्थानिक आइसोमर्स होते हैं?
आइसोमरों- समान आणविक संरचना वाले पदार्थ, लेकिन विभिन्न रासायनिक संरचना और गुण।
समरूपता के प्रकार
मैं. संरचनात्मक - एक अणु की श्रृंखला में परमाणुओं के कनेक्शन के विभिन्न अनुक्रम में निहित है:
1)श्रृंखला समावयवता
यह ध्यान दिया जाना चाहिए कि शाखित श्रृंखला में कार्बन परमाणु अन्य कार्बन परमाणुओं के साथ संबंध के प्रकार में भिन्न होते हैं। इस प्रकार, केवल एक अन्य कार्बन परमाणु से बंधा हुआ कार्बन परमाणु कहलाता है प्राथमिक, दो अन्य कार्बन परमाणुओं के साथ - माध्यमिक, तीन के साथ - तृतीयक, चार के साथ - चारों भागों का.
2) स्थिति समावयवता

3) अंतरवर्गीय समावयवता
4) टॉटोमेरिज्म
टॉटोमेरिज़्म(ग्रीक ταύτίς से - वही और μέρος - माप) - प्रतिवर्ती आइसोमेरिज्म की घटना, जिसमें दो या दो से अधिक आइसोमर्स आसानी से एक दूसरे में बदल जाते हैं। इस मामले में, एक टॉटोमेरिक संतुलन स्थापित होता है, और पदार्थ में एक साथ एक निश्चित अनुपात में सभी आइसोमर्स के अणु होते हैं। अक्सर, टॉटोमेराइजेशन में एक अणु में एक परमाणु से दूसरे में और फिर से उसी यौगिक में हाइड्रोजन परमाणुओं की गति शामिल होती है।
द्वितीय. स्थानिक (स्टीरियो) - जुड़े हुए कार्बन परमाणुओं के मुक्त घूर्णन को छोड़कर, एक दोहरे बंधन या रिंग के सापेक्ष परमाणुओं या समूहों की विभिन्न स्थितियों के कारण
1. ज्यामितीय (सीआईएस -, ट्रांस - आइसोमेरिज्म)

यदि किसी अणु में एक कार्बन परमाणु चार अलग-अलग परमाणुओं या परमाणु समूहों से बंधा होता है, उदाहरण के लिए:
तब समान संरचनात्मक सूत्र वाले, लेकिन स्थानिक संरचना में भिन्न दो यौगिकों का अस्तित्व संभव है। ऐसे यौगिकों के अणु एक वस्तु और उसकी दर्पण छवि के रूप में एक दूसरे से संबंधित होते हैं और स्थानिक आइसोमर्स होते हैं।
इस प्रकार के समावयवता को ऑप्टिकल कहा जाता है; आइसोमर्स को ऑप्टिकल आइसोमर्स या ऑप्टिकल एंटीपोड कहा जाता है:
ऑप्टिकल आइसोमर्स के अणु अंतरिक्ष में असंगत होते हैं (जैसे बाएँ और दाएँ हाथ); उनमें समरूपता के तल का अभाव होता है।
इस प्रकार,
- ऑप्टिकल आइसोमर्सस्थानिक आइसोमर्स कहलाते हैं, जिनके अणु एक वस्तु और एक असंगत दर्पण छवि के रूप में एक दूसरे से संबंधित होते हैं।

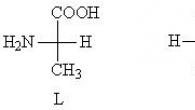
अमीनो एसिड के ऑप्टिकल आइसोमर्स
3. गठनात्मक समावयवता
यह ध्यान दिया जाना चाहिए कि σ बांड द्वारा एक दूसरे से जुड़े परमाणु और परमाणुओं के समूह लगातार बांड अक्ष के सापेक्ष घूमते हैं, एक दूसरे के सापेक्ष अंतरिक्ष में विभिन्न पदों पर कब्जा करते हैं।
वे अणु जिनकी संरचना समान होती है और सी-सी बांड के चारों ओर घूमने के परिणामस्वरूप परमाणुओं की स्थानिक व्यवस्था में भिन्नता होती है, कन्फर्मर कहलाते हैं।
गठनात्मक आइसोमर्स को चित्रित करने के लिए, सूत्रों का उपयोग करना सुविधाजनक है - न्यूमैन अनुमान:
गठनात्मक समावयवता की घटना को साइक्लोअल्केन्स के उदाहरण का उपयोग करके भी माना जा सकता है। इस प्रकार, साइक्लोहेक्सेन की विशेषता निम्नलिखित अनुरूपकों द्वारा की जाती है:
कार्बनिक पदार्थों का वर्णन करने वाले सूत्रों के प्रकार जिनकी हमने पहले जांच की थी, यह दर्शाता है कि कई अलग-अलग संरचनात्मक सूत्र एक आणविक सूत्र के अनुरूप हो सकते हैं।
उदाहरण के लिए, आणविक सूत्र सी2एच6हेअनुरूप दो पदार्थविभिन्न संरचनात्मक सूत्रों के साथ - एथिल अल्कोहल और डाइमिथाइल ईथर। चावल। 1.
एथिल अल्कोहल एक तरल है जो सोडियम धातु के साथ प्रतिक्रिया करके हाइड्रोजन छोड़ता है और +78.50C पर उबलता है। समान परिस्थितियों में, डाइमिथाइल ईथर, एक गैस जो सोडियम के साथ प्रतिक्रिया नहीं करती है, -230C पर उबलती है।
ये पदार्थ अपनी संरचना में भिन्न होते हैं - विभिन्न पदार्थों का आणविक सूत्र समान होता है।

चावल। 1. अंतरवर्गीय समावयवता
ऐसे पदार्थों के अस्तित्व की घटना जिनकी संरचना समान है, लेकिन अलग-अलग संरचनाएं हैं और इसलिए अलग-अलग गुण हैं, आइसोमेरिज्म कहलाते हैं (ग्रीक शब्द "आइसोस" से - "बराबर" और "मेरोस" - "भाग", "शेयर")।
समरूपता के प्रकार
समावयवता विभिन्न प्रकार की होती है।
संरचनात्मक समावयवता एक अणु में परमाणुओं के जुड़ने के एक अलग क्रम से जुड़ी होती है।
इथेनॉल और डाइमिथाइल ईथर संरचनात्मक आइसोमर्स हैं। चूँकि वे कार्बनिक यौगिकों के विभिन्न वर्गों से संबंधित हैं, इसलिए इस प्रकार की संरचनात्मक समावयवता कहलाती है इंटरक्लास भी . चावल। 1.
संरचनात्मक आइसोमर्स भी यौगिकों के एक ही वर्ग में मौजूद हो सकते हैं, उदाहरण के लिए, सूत्र C5H12 तीन अलग-अलग हाइड्रोकार्बन से मेल खाता है। यह कार्बन कंकाल समरूपता. चावल। 2.

चावल। 2 पदार्थों के उदाहरण - संरचनात्मक आइसोमर्स
समान कार्बन कंकाल वाले संरचनात्मक आइसोमर्स होते हैं, जो हाइड्रोजन की जगह लेने वाले कई बांडों (डबल और ट्रिपल) या परमाणुओं की स्थिति में भिन्न होते हैं। इस प्रकार की संरचनात्मक समावयवता कहलाती है स्थितीय समरूपता.
चावल। 3. संरचनात्मक स्थिति समरूपता
केवल एकल बांड वाले अणुओं में, कमरे के तापमान पर बांड के चारों ओर आणविक टुकड़ों का लगभग मुक्त घूमना संभव है, और, उदाहरण के लिए, 1,2-डाइक्लोरोइथेन के सूत्रों की सभी छवियां समतुल्य हैं। चावल। 4

चावल। 4. एकल आबंध के चारों ओर क्लोरीन परमाणुओं की स्थिति
यदि घूर्णन में बाधा आती है, उदाहरण के लिए, चक्रीय अणु में या दोहरे बंधन के साथ, तो ज्यामितीय या सीआईएस-ट्रांस आइसोमेरिज्म।सीआईएस-आइसोमर्स में, प्रतिस्थापन रिंग या डबल बॉन्ड के विमान के एक तरफ स्थित होते हैं, ट्रांस-आइसोमर्स में - विपरीत पक्षों पर।
सीआईएस-ट्रांस आइसोमर्स तब मौजूद होते हैं जब वे कार्बन परमाणु से बंधे होते हैं। दो अलगउप चावल। 5.



चावल। 5. सीआईएस और ट्रांस आइसोमर्स
एक अन्य प्रकार की समावयवता इस तथ्य के कारण उत्पन्न होती है कि चार एकल बंधों वाला एक कार्बन परमाणु अपने प्रतिस्थापनों के साथ एक स्थानिक संरचना बनाता है - एक टेट्राहेड्रोन। यदि एक अणु में कम से कम एक कार्बन परमाणु चार अलग-अलग प्रतिस्थापनों से बंधा हुआ है, ऑप्टिकल समरूपता. ऐसे अणु अपनी दर्पण छवि से मेल नहीं खाते। इस संपत्ति को ग्रीक से चिरैलिटी कहा जाता है साथयहाँ- "हाथ"। चावल। 6. ऑप्टिकल आइसोमेरिज्म कई अणुओं की विशेषता है जो जीवित जीवों को बनाते हैं।
|
|
|
चावल। 6. ऑप्टिकल आइसोमर्स के उदाहरण
ऑप्टिकल आइसोमेरिज्म भी कहा जाता है enantiomerism (ग्रीक से enantios- "विपरीत" और मेरोस- "भाग"), और ऑप्टिकल आइसोमर्स - एनंटीओमर . एनैन्टीओमर्स वैकल्पिक रूप से सक्रिय हैं; वे प्रकाश के ध्रुवीकरण के तल को एक ही कोण से घुमाते हैं, लेकिन विपरीत दिशाओं में: डी- , या (+)-आइसोमर, - दाईं ओर, एल , या (-)-आइसोमर, - बाईं ओर। एनैन्टीओमर्स की समान मात्रा का मिश्रण कहलाता है रेसमेट, वैकल्पिक रूप से निष्क्रिय है और प्रतीक द्वारा दर्शाया गया है डी,एल- या (±).
सूत्रों का कहना है
वीडियो स्रोत - http://www.youtube.com/watch?v=mGS8BUEvkpY
http://www.youtube.com/watch?t=7&v=XIikCzDD1YE
http://interneturok.ru/ru/school/chemistry/10-klass - सार
प्रस्तुति स्रोत - http://ppt4web.ru/khimija/tipy-izomerii.html
http://www.youtube.com/watch?t=2&v=ii30Pctj6Xs
http://www.youtube.com/watch?t=1&v=v1voBxeVmao
http://www.youtube.com/watch?t=2&v=a55MfdjCa5Q
http://www.youtube.com/watch?t=1&v=FtMA1IJtXCE
प्रस्तुति स्रोत - http://mirhiii.ru/10class/174-izomeria.html
बाल चिकित्सा संकाय के छात्रों के लिए व्याख्यान
भाषण2
विषय: कार्बनिक यौगिकों की स्थानिक संरचना
लक्ष्य:कार्बनिक यौगिकों के संरचनात्मक और स्थानिक समरूपता के प्रकारों से परिचित होना।
योजना:
समावयवता का वर्गीकरण.
संरचनात्मक समरूपता.
स्थानिक समरूपता
ऑप्टिकल समरूपता
कार्बनिक अणुओं की संरचना को समझने का पहला प्रयास 19वीं शताब्दी की शुरुआत में हुआ। आइसोमेरिज्म की घटना की खोज सबसे पहले जे. बर्ज़ेलियस ने की थी और 1861 में ए. एम. बटलरोव ने कार्बनिक यौगिकों की रासायनिक संरचना का एक सिद्धांत प्रस्तावित किया था, जिसने आइसोमेरिज्म की घटना को समझाया।
समावयवता समान गुणात्मक और मात्रात्मक संरचना, लेकिन अंतरिक्ष में भिन्न संरचना या स्थान वाले यौगिकों का अस्तित्व है, और पदार्थों को स्वयं समावयवी कहा जाता है।
आइसोमर्स का वर्गीकरण
संरचनात्मक
(परमाणुओं के कनेक्शन का अलग क्रम)
स्टीरियोइसोमेरिज़्म
(अंतरिक्ष में परमाणुओं की अलग व्यवस्था)
एकाधिक कनेक्शन प्रावधान
कार्यात्मक समूह प्रावधान
विन्यास
अनुरूपता-
संरचनात्मक समरूपता.
संरचनात्मक आइसोमर्स ऐसे आइसोमर्स होते हैं जिनकी गुणात्मक और मात्रात्मक संरचना समान होती है, लेकिन रासायनिक संरचना में भिन्न होती है।
संरचनात्मक समावयवता कार्बनिक यौगिकों की विविधता को निर्धारित करती है, विशेष रूप से अल्केन्स में। अणुओं में कार्बन परमाणुओं की संख्या में वृद्धि के साथअल्केन्स, संरचनात्मक आइसोमर्स की संख्या तेजी से बढ़ती है। तो, हेक्सेन (सी 6 एच 14) के लिए यह 5 है, नॉनेन (सी 9 एच 20) के लिए - 35।
श्रृंखला में कार्बन परमाणुओं का स्थान अलग-अलग होता है। श्रृंखला की शुरुआत में कार्बन परमाणु एक कार्बन परमाणु से बंधा होता है और कहलाता है प्राथमिक।एक कार्बन परमाणु दो कार्बन परमाणुओं से बंधा हुआ है - माध्यमिक, तीन के साथ - तृतीयक, चार के साथ - चारों भागों का. सीधी-श्रृंखला वाले अल्केन्स में केवल प्राथमिक और द्वितीयक कार्बन परमाणु होते हैं, जबकि शाखा-श्रृंखला वाले अल्केन्स में तृतीयक और चतुर्धातुक दोनों कार्बन परमाणु होते हैं।
संरचनात्मक समरूपता के प्रकार.

मेटामर्स- यौगिकों के एक ही वर्ग से संबंधित यौगिक, लेकिन विभिन्न मूलांक वाले:
एच 3 सी - ओ - सी 3 एच 7 - मिथाइलप्रोपाइल ईथर,
एच 5 सी 2 - ओ - सी 2 एच 5 - डायथाइल ईथर
अंतरवर्गीय समावयवता.अणुओं की समान गुणात्मक और मात्रात्मक संरचना के बावजूद, पदार्थों की संरचना भिन्न होती है।
उदाहरण के लिए: एल्डिहाइड कीटोन के लिए आइसोमेरिक हैं:
एल्काइन्स - एल्केडिएन्स
एच 2 सी = सीएच - सीएच = सीएच 2 ब्यूटाडीन -1.3 एचसी = सी - सीएच 2 - सीएच 3 - ब्यूटिन-1
संरचनात्मक समावयवता हाइड्रोकार्बन रेडिकल्स की विविधता को भी निर्धारित करती है। रेडिकल्स की समावयवता प्रोपेन से शुरू होती है, जिसके लिए दो रेडिकल संभव हैं। यदि प्राथमिक कार्बन परमाणु से हाइड्रोजन परमाणु घटाया जाए, तो रेडिकल प्रोपाइल (एन-प्रोपाइल) प्राप्त होता है। यदि एक हाइड्रोजन परमाणु को द्वितीयक कार्बन परमाणु से घटाया जाता है, तो रेडिकल आइसोप्रोपिल प्राप्त होता है।
-
isopropyl
सीएच 2 - सीएच 2 - सीएच 3 - काटेंस्थानिक समावयवता (स्टीरियोआइसोमेरिज्म)
यह उन आइसोमर्स का अस्तित्व है जिनकी संरचना और परमाणुओं के कनेक्शन का क्रम समान है, लेकिन एक दूसरे के सापेक्ष अंतरिक्ष में परमाणुओं या परमाणुओं के समूहों की व्यवस्था की प्रकृति में भिन्नता है।
इस प्रकार की समावयवता का वर्णन एल. पाश्चर (1848), जे. वान्ट हॉफ, ले बेल (1874) द्वारा किया गया था।
वास्तविक परिस्थितियों में, अणु स्वयं और उसके अलग-अलग हिस्से (परमाणु, परमाणुओं के समूह) कंपन-घूर्णी गति की स्थिति में होते हैं, और यह गति अणु में परमाणुओं की सापेक्ष व्यवस्था को काफी हद तक बदल देती है। इस समय, रासायनिक बंधन खिंचते हैं और बंधन कोण बदलते हैं, और इस प्रकार अणुओं के विभिन्न विन्यास और संरचनाएं उत्पन्न होती हैं।
इसलिए, स्थानिक आइसोमर्स को दो प्रकारों में विभाजित किया गया है: गठनात्मक और विन्यासात्मक।
कॉन्फ़िगरेशन वह क्रम है जिसमें परमाणुओं को एकल बांड के चारों ओर घूमने के परिणामस्वरूप होने वाले अंतर को ध्यान में रखे बिना अंतरिक्ष में व्यवस्थित किया जाता है।ये आइसोमर्स विभिन्न संरचनाओं में मौजूद हैं।
अनुरूपण एक ही अणु के बहुत अस्थिर गतिशील रूप हैं जो एकल बंधों के चारों ओर परमाणुओं या परमाणुओं के समूहों के घूमने के परिणामस्वरूप उत्पन्न होते हैं, जिसके परिणामस्वरूप परमाणु विभिन्न स्थानिक स्थिति पर कब्जा कर लेते हैं। एक अणु की प्रत्येक संरचना एक विशिष्ट विन्यास की विशेषता होती है।
बी-बॉन्ड इसके चारों ओर घूमने की अनुमति देता है, इसलिए एक अणु में कई संरचनाएं हो सकती हैं। कई अनुरूपताओं में से, केवल छह को ध्यान में रखा जाता है, क्योंकि घूर्णन का न्यूनतम कोण 60° के बराबर कोण माना जाता है, जिसे कहते हैं मरोड़ कोण.
ये हैं: ग्रहण की गई और बाधित रचनाएँ।
ग्रहण की गई रचना तब होता है जब समान पदार्थ एक दूसरे से न्यूनतम दूरी पर स्थित होते हैं और उनके बीच पारस्परिक प्रतिकर्षण बल उत्पन्न होते हैं, और इस संरचना को बनाए रखने के लिए अणु में ऊर्जा की एक बड़ी आपूर्ति होनी चाहिए। यह संरचना ऊर्जावान रूप से प्रतिकूल है।
बाधित रचना - तब होता है जब समान पदार्थ एक-दूसरे से यथासंभव दूर होते हैं और अणु में न्यूनतम ऊर्जा आरक्षित होती है। यह संरचना ऊर्जावान रूप से अनुकूल है।
पी 
 पहला यौगिक जिसके लिए गठनात्मक आइसोमर्स का अस्तित्व ज्ञात है, वह ईथेन है। अंतरिक्ष में इसकी संरचना को परिप्रेक्ष्य सूत्र या न्यूमैन के सूत्र द्वारा दर्शाया गया है:
पहला यौगिक जिसके लिए गठनात्मक आइसोमर्स का अस्तित्व ज्ञात है, वह ईथेन है। अंतरिक्ष में इसकी संरचना को परिप्रेक्ष्य सूत्र या न्यूमैन के सूत्र द्वारा दर्शाया गया है:
साथ 2 एन 6
अस्पष्ट अवरोधित
रचना रचना

न्यूमैन के प्रक्षेपण सूत्र.
हमारे निकटतम कार्बन परमाणु को वृत्त के केंद्र में एक बिंदु द्वारा निर्दिष्ट किया जाता है, वृत्त दूर के कार्बन परमाणु का प्रतिनिधित्व करता है। प्रत्येक परमाणु के तीन बंधनों को वृत्त के केंद्र से निकलने वाली रेखाओं के रूप में दर्शाया गया है - निकटतम कार्बन परमाणु के लिए और छोटे वाले - दूर के कार्बन परमाणु के लिए।
लंबी कार्बन श्रृंखलाओं में, कई सी-सी बांडों के आसपास घूमना संभव है। इसलिए, पूरी श्रृंखला विभिन्न प्रकार के ज्यामितीय आकार ले सकती है। एक्स-रे विवर्तन डेटा के अनुसार, संतृप्त हाइड्रोकार्बन की लंबी श्रृंखलाओं में ज़िगज़ैग और पंजे के आकार की संरचना होती है। उदाहरण के लिए: पामिटिक (C 15 H 31 COOH) और स्टीयरिक (C 17 H 35 COOH) एसिड ज़िगज़ैग संरचना में कोशिका झिल्ली के लिपिड का हिस्सा होते हैं, और समाधान में मोनोसैकराइड अणु एक पंजे के आकार की संरचना लेते हैं।
चक्रीय यौगिकों की संरचना
चक्रीय कनेक्शन को एक बंद चक्र की उपस्थिति से जुड़े कोणीय तनाव की विशेषता होती है।
यदि हम चक्रों को सपाट मानते हैं, तो उनमें से कई के लिए बंधन कोण सामान्य से काफी विचलित हो जाएंगे। वलय में कार्बन परमाणुओं के बीच बंध कोणों के सामान्य मान से विचलन के कारण उत्पन्न तनाव को कहा जाता है कोनाया बायर का.
उदाहरण के लिए, साइक्लोहेक्सेन में कार्बन परमाणु एसपी 3 संकर अवस्था में हैं और, तदनुसार, बंधन कोण 109 o 28 / के बराबर होना चाहिए। यदि कार्बन परमाणु एक ही तल में हों, तो समतल वलय में आंतरिक बंधन कोण 120° के बराबर होंगे, और सभी हाइड्रोजन परमाणु एक ग्रहण संरचना में होंगे। लेकिन मजबूत कोणीय और मरोड़ वाले तनाव की उपस्थिति के कारण साइक्लोहेक्सेन समतल नहीं हो सकता। यह ϭ-बॉन्ड के चारों ओर आंशिक घूर्णन के कारण कम तनावग्रस्त गैर-प्लानर संरचना विकसित करता है, जिसके बीच संरचना अधिक स्थिर होती है आर्मचेयर और स्नान.
कुर्सी की संरचना सबसे ऊर्जावान रूप से अनुकूल है, क्योंकि इसमें हाइड्रोजन और कार्बन परमाणुओं की अवरूद्ध स्थिति नहीं होती है। सभी C परमाणुओं के H परमाणुओं की व्यवस्था ईथेन की बाधित रचना के समान ही है। इस संरचना में, सभी हाइड्रोजन परमाणु खुले होते हैं और प्रतिक्रियाओं के लिए उपलब्ध होते हैं।
स्नान संरचना कम ऊर्जावान रूप से अनुकूल है, क्योंकि आधार पर स्थित C परमाणुओं के 2 जोड़े (C-2 और C-3), (C-5 और C-6) में ग्रहण संरचना में H परमाणु होते हैं, इसलिए यह संरचना बड़ी होती है ऊर्जा का भंडार और अस्थिर.
सी 6 एच 12 साइक्लोहेक्सेन
"कुर्सी" का आकार "बाथटब" की तुलना में अधिक ऊर्जावान रूप से फायदेमंद है।
ऑप्टिकल समरूपता.
19वीं शताब्दी के अंत में, यह पता चला कि कई कार्बनिक यौगिक ध्रुवीकृत किरण के तल को बाएँ और दाएँ घुमाने में सक्षम हैं। अर्थात्, किसी अणु पर आपतित प्रकाश किरण उसके इलेक्ट्रॉन कोशों के साथ संपर्क करती है, और इलेक्ट्रॉनों का ध्रुवीकरण होता है, जिससे विद्युत क्षेत्र में दोलनों की दिशा में परिवर्तन होता है। यदि कोई पदार्थ कंपन के तल को दक्षिणावर्त घुमाता है, तो उसे कहा जाता है डेक्सट्रोटोटेट्री(+) यदि वामावर्त - बाएं हाथ से काम करने वाला(-). इन पदार्थों को ऑप्टिकल आइसोमर्स कहा जाता था। प्रकाशिक रूप से सक्रिय आइसोमर्स में एक असममित कार्बन परमाणु (चिरल) होता है - यह एक परमाणु है जिसमें चार अलग-अलग प्रतिस्थापन होते हैं। दूसरी महत्वपूर्ण शर्त सभी प्रकार की समरूपता (अक्ष, तल) का अभाव है। इनमें कई हाइड्रॉक्सी और अमीनो एसिड शामिल हैं
अध्ययनों से पता चला है कि ऐसे यौगिक एसपी 3 संकरण में कार्बन परमाणुओं पर प्रतिस्थापन के क्रम में भिन्न होते हैं।
पी  सबसे सरल यौगिक लैक्टिक एसिड (2-हाइड्रॉक्सीप्रोपेनोइक एसिड) है
सबसे सरल यौगिक लैक्टिक एसिड (2-हाइड्रॉक्सीप्रोपेनोइक एसिड) है
स्टीरियोइसोमर्स जिनके अणु एक वस्तु और एक असंगत दर्पण छवि या बाएं और दाएं हाथ के रूप में एक दूसरे से संबंधित होते हैं, कहलाते हैं एनंटीओमर(ऑप्टिकल आइसोमर्स, मिरर आइसोमर्स, एंटीपोड्स और घटना को कहा जाता है enantiomerism.एनैन्टीओमर्स के सभी रासायनिक और भौतिक गुण समान हैं, दो को छोड़कर: ध्रुवीकृत प्रकाश के तल का घूमना (एक ध्रुवमापी उपकरण में) और जैविक गतिविधि।
अणुओं का पूर्ण विन्यास जटिल भौतिक-रासायनिक विधियों द्वारा निर्धारित किया जाता है।
वैकल्पिक रूप से सक्रिय यौगिकों का सापेक्ष विन्यास ग्लिसराल्डिहाइड मानक के साथ तुलना करके निर्धारित किया जाता है। डेक्सट्रोरोटेटरी या लेवरोटेटरी ग्लिसराल्डिहाइड (एम. रोज़ानोव, 1906) के विन्यास वाले ऑप्टिकली सक्रिय पदार्थों को डी- और एल-श्रृंखला के पदार्थ कहा जाता है। एक यौगिक के डेक्सट्रो- और लेवोरोटरी आइसोमर्स के बराबर मिश्रण को रेसमेट कहा जाता है और यह ऑप्टिकली निष्क्रिय होता है।
अध्ययनों से पता चला है कि प्रकाश के घूमने का संकेत किसी पदार्थ के डी- और एल-श्रृंखला से संबंधित नहीं हो सकता है, यह केवल प्रयोगात्मक रूप से उपकरणों - पोलिमीटर में निर्धारित किया जाता है; उदाहरण के लिए, एल-लैक्टिक एसिड का घूर्णन कोण +3.8 o, डी-लैक्टिक एसिड - 3.8 o है।
एनैन्टीओमर्स को फिशर के सूत्रों का उपयोग करके दर्शाया गया है।
कार्बन श्रृंखला को एक ऊर्ध्वाधर रेखा द्वारा दर्शाया जाता है।
वरिष्ठ कार्यात्मक समूह को शीर्ष पर रखा गया है, कनिष्ठ कार्यात्मक समूह को सबसे नीचे रखा गया है।
एक असममित कार्बन परमाणु को एक क्षैतिज रेखा द्वारा दर्शाया जाता है, जिसके सिरों पर प्रतिस्थापन होते हैं।
आइसोमर्स की संख्या सूत्र 2 n द्वारा निर्धारित की जाती है, n असममित कार्बन परमाणुओं की संख्या है।


एल-पंक्ति डी-पंक्ति
एनैन्टीओमर्स के बीच सममित अणु हो सकते हैं जिनमें ऑप्टिकल गतिविधि नहीं होती है, और उन्हें कहा जाता है मेसोइसोमर्स.

|
उदाहरण के लिए: वाइन हाउस |

|
डी - (+) - पंक्ति एल - (-) - पंक्ति |
मेज़ोविन्नाया के-टा |
रेसमेट - अंगूर का रस
ऑप्टिकल आइसोमर्स जो दर्पण आइसोमर्स नहीं हैं, कई के विन्यास में भिन्न होते हैं, लेकिन सभी असममित सी परमाणु नहीं होते हैं, जिनमें विभिन्न भौतिक और रासायनिक गुण होते हैं, उन्हें - कहा जाता है डि-ए-स्टीरियोइसोमर्स.
-डायस्टेरेओमर्स (ज्यामितीय आइसोमर्स) स्टीरियोमर्स हैं जिनके अणु में बंधन होता है। वे एल्केन्स, असंतृप्त उच्च कार्बन यौगिकों, असंतृप्त डाइकार्बोनिक यौगिकों में पाए जाते हैं। उदाहरण के लिए:

सीआईएस-ब्यूटेन-2 ट्रांस-ब्यूटेन-2
कार्बनिक पदार्थों की जैविक गतिविधि उनकी संरचना से संबंधित होती है। उदाहरण के लिए:

सीस-ब्यूटेनेडिक एसिड, ट्रांस-ब्यूटेनेडिक एसिड,
मैलिक एसिड - फ्यूमरिक एसिड - गैर विषैले,
शरीर में बहुत जहरीला पाया जाता है
सभी प्राकृतिक असंतृप्त उच्च कार्बन यौगिक सीआईएस-आइसोमर्स हैं।
सिद्धांत ए.एम. बटलरोव
1. अणुओं में परमाणु अपनी संयोजकता के अनुसार रासायनिक बंधों द्वारा एक निश्चित क्रम में एक दूसरे से जुड़े होते हैं। परमाणुओं के जुड़ने के क्रम को उनकी रासायनिक संरचना कहा जाता है। सभी कार्बनिक यौगिकों में कार्बन टेट्रावेलेंट होता है।
2. पदार्थों के गुण न केवल अणुओं की गुणात्मक और मात्रात्मक संरचना से, बल्कि उनकी संरचना से भी निर्धारित होते हैं।
3. परमाणु या परमाणुओं के समूह परस्पर एक दूसरे को प्रभावित करते हैं, जिससे अणु की प्रतिक्रियाशीलता निर्धारित होती है।
4. अणुओं की संरचना उनके रासायनिक गुणों के अध्ययन के आधार पर स्थापित की जा सकती है।
कार्बनिक यौगिकों में कई विशिष्ट विशेषताएं होती हैं जो उन्हें अकार्बनिक यौगिकों से अलग करती हैं। उनमें से लगभग सभी (दुर्लभ अपवादों को छोड़कर) ज्वलनशील हैं; अधिकांश कार्बनिक यौगिक आयनों में वियोजित नहीं होते हैं, जो कार्बनिक पदार्थों में सहसंयोजक बंधों की प्रकृति के कारण होता है। आयनिक प्रकार का बंधन केवल कार्बनिक अम्लों के लवणों में ही साकार होता है, उदाहरण के लिए, CH3COONa।
सजातीय श्रृंखला- यह कार्बनिक यौगिकों की एक अंतहीन श्रृंखला है जिनकी संरचना समान होती है और इसलिए, समान रासायनिक गुण होते हैं और CH2- समूहों (समरूप अंतर) की किसी भी संख्या द्वारा एक दूसरे से भिन्न होते हैं।

संरचना के सिद्धांत के निर्माण से पहले भी, समान मौलिक संरचना वाले, लेकिन विभिन्न गुणों वाले पदार्थ ज्ञात थे। ऐसे पदार्थों को आइसोमर्स कहा जाता था और इस घटना को ही आइसोमेरिज्म कहा जाता था।
समरूपता का आधार, जैसा कि ए.एम. द्वारा दिखाया गया है। बटलरोव के अनुसार, समान परमाणुओं के समूह से बने अणुओं की संरचना में अंतर निहित है।
संवयविता- यह उन यौगिकों के अस्तित्व की घटना है जिनकी गुणात्मक और मात्रात्मक संरचना समान है, लेकिन संरचनाएं अलग हैं और इसलिए, अलग-अलग गुण हैं।


समावयवता के 2 प्रकार हैं: संरचनात्मकसमरूपता और स्थानिकसमरूपता.
संरचनात्मक समरूपता
संरचनात्मक आइसोमर्स- समान गुणात्मक और मात्रात्मक संरचना के यौगिक, परमाणुओं के बंधन के क्रम में भिन्न, यानी रासायनिक संरचना।

स्थानिक समरूपता
स्थानिक आइसोमर्स(स्टीरियोइसोमर्स) समान संरचना और समान रासायनिक संरचना के साथ अणु में परमाणुओं की स्थानिक व्यवस्था में भिन्न होते हैं।
स्थानिक आइसोमर्स ऑप्टिकल और सीआईएस-ट्रांस आइसोमर्स (ज्यामितीय) हैं।
सीआईएस-ट्रांस आइसोमेरिज्म
दोहरे बंधन या गैर-सुगंधित वलय बी के तल के एक या विपरीत दिशा में प्रतिस्थापकों को रखने की संभावना में निहित है सीआईएस आइसोमर्सप्रतिस्थापक रिंग या डबल बॉन्ड के तल के एक तरफ होते हैं ट्रांस आइसोमर्स- अलग - अलग तरीकों से।

ब्यूटेन-2 अणु CH3–CH=CH–CH3 में, CH3 समूह या तो दोहरे बंधन के एक तरफ - सीआईएस आइसोमर में, या विपरीत पक्षों पर - ट्रांस आइसोमर में स्थित हो सकते हैं।
ऑप्टिकल समरूपता
तब प्रकट होता है जब एक कार्बन में चार अलग-अलग प्रतिस्थापन होते हैं।
यदि आप उनमें से किन्हीं दो की अदला-बदली करते हैं, तो आपको उसी संरचना का एक और स्थानिक आइसोमर मिलता है। ऐसे आइसोमर्स के भौतिक-रासायनिक गुण काफी भिन्न होते हैं। इस प्रकार के यौगिकों को एक निश्चित मात्रा में ऐसे यौगिकों के समाधान के माध्यम से प्रेषित ध्रुवीकृत प्रकाश के विमान को घुमाने की उनकी क्षमता से अलग किया जाता है। इस मामले में, एक आइसोमर ध्रुवीकृत प्रकाश के तल को एक दिशा में घुमाता है, और इसका आइसोमर विपरीत दिशा में घूमता है। ऐसे ऑप्टिकल प्रभावों के कारण इस प्रकार की समावयवता को ऑप्टिकल समावयवता कहा जाता है। 
लेख की सामग्री
आइसोमेरिया(ग्रीक आइसोस - समरूप, मेरोस - भाग) रसायन विज्ञान में सबसे महत्वपूर्ण अवधारणाओं में से एक है, मुख्य रूप से कार्बनिक में। पदार्थों की संरचना और आणविक भार समान हो सकते हैं, लेकिन विभिन्न संरचनाएं और यौगिक जिनमें समान मात्रा में समान तत्व होते हैं, लेकिन परमाणुओं या परमाणुओं के समूहों की स्थानिक व्यवस्था में भिन्नता होती है, आइसोमर्स कहलाते हैं। समावयवता उन कारणों में से एक है जिसके कारण कार्बनिक यौगिक इतने असंख्य और विविध हैं।
आइसोमेरिज्म की खोज सबसे पहले 1823 में जे. लिबिग ने की थी, जिन्होंने स्थापित किया था कि फुलमिनेट और आइसोसायनिक एसिड के सिल्वर लवण: Ag-O-N=C और Ag-N=C=O की संरचना समान है, लेकिन गुण अलग-अलग हैं। शब्द "आइसोमेरिज्म" 1830 में आई. बर्ज़ेलियस द्वारा पेश किया गया था, जिन्होंने सुझाव दिया था कि एक ही संरचना के यौगिकों के गुणों में अंतर इस तथ्य के कारण उत्पन्न होता है कि अणु में परमाणु एक अलग क्रम में व्यवस्थित होते हैं। आइसोमेरिज्म का विचार अंततः ए.एम. बटलरोव द्वारा रासायनिक संरचना (1860 के दशक) के सिद्धांत के निर्माण के बाद बना। इस सिद्धांत के आधार पर, उन्होंने प्रस्तावित किया कि चार अलग-अलग ब्यूटेनॉल होने चाहिए (चित्र 1)। जब सिद्धांत बनाया गया था, तब तक केवल एक ब्यूटेनॉल (सीएच 3) 2 सीएचसीएच 2 ओएच ज्ञात था, जो पौधों की सामग्री से प्राप्त किया गया था।
चावल। 1. ब्यूटेनॉल आइसोमर्स
सभी ब्यूटेनॉल आइसोमर्स का बाद का संश्लेषण और उनके गुणों का निर्धारण सिद्धांत की ठोस पुष्टि बन गया।
आधुनिक परिभाषा के अनुसार, एक ही संरचना के दो यौगिकों को आइसोमर्स माना जाता है यदि उनके अणुओं को अंतरिक्ष में संयोजित नहीं किया जा सकता है ताकि वे पूरी तरह से मेल खा सकें। संयोजन, एक नियम के रूप में, मानसिक रूप से किया जाता है; जटिल मामलों में, स्थानिक मॉडल या गणना विधियों का उपयोग किया जाता है।
समरूपता के कई कारण हैं।
संरचनात्मक समरूपता
एक नियम के रूप में, यह हाइड्रोकार्बन कंकाल की संरचना में अंतर या कार्यात्मक समूहों या एकाधिक बांडों की असमान व्यवस्था के कारण होता है।
हाइड्रोकार्बन कंकाल का समरूपता.
एक से तीन कार्बन परमाणुओं (मीथेन, ईथेन, प्रोपेन) वाले संतृप्त हाइड्रोकार्बन में कोई आइसोमर नहीं होता है। चार कार्बन परमाणुओं सी 4 एच 10 (ब्यूटेन) वाले यौगिक के लिए, दो आइसोमर्स संभव हैं, पेंटेन सी 5 एच 12 के लिए - तीन आइसोमर्स, हेक्सेन सी 6 एच 14 के लिए - पांच (छवि 2):
चावल। 2. सरलतम हाइड्रोकार्बन के आइसोमर्स
जैसे ही हाइड्रोकार्बन अणु में कार्बन परमाणुओं की संख्या बढ़ती है, संभावित आइसोमर्स की संख्या नाटकीय रूप से बढ़ जाती है। हेप्टेन सी 7 एच 16 के लिए नौ आइसोमर्स हैं, हाइड्रोकार्बन सी 14 एच 30 के लिए 1885 आइसोमर्स हैं, हाइड्रोकार्बन सी 20 एच 42 के लिए 366,000 से अधिक हैं।
जटिल मामलों में, यह प्रश्न कि क्या दो यौगिक आइसोमर्स हैं, वैलेंस बांड के चारों ओर विभिन्न घुमावों का उपयोग करके हल किया जाता है (सरल बांड इसकी अनुमति देते हैं, जो कुछ हद तक उनके भौतिक गुणों से मेल खाते हैं)। अणु के अलग-अलग टुकड़ों को स्थानांतरित करने के बाद (बंधन को तोड़े बिना), एक अणु दूसरे पर आरोपित हो जाता है (चित्र 3)। यदि दो अणु पूरी तरह से समान हैं, तो ये आइसोमर्स नहीं हैं, बल्कि एक ही यौगिक हैं:
कंकाल संरचना में भिन्न आइसोमर्स में आमतौर पर अलग-अलग भौतिक गुण (गलनांक, क्वथनांक, आदि) होते हैं, जिससे एक को दूसरे से अलग करना संभव हो जाता है। इस प्रकार की समावयवता सुगंधित हाइड्रोकार्बन में भी मौजूद है (चित्र 4):
चावल। 4. सुगंधित आइसोमर्स
स्थितीय समरूपता.
एक अन्य प्रकार की संरचनात्मक समावयवता, स्थितीय समावयवता, उन मामलों में होती है जहां कार्यात्मक समूह, व्यक्तिगत हेटेरोएटम या कई बंधन हाइड्रोकार्बन कंकाल में विभिन्न स्थानों पर स्थित होते हैं। संरचनात्मक आइसोमर्स कार्बनिक यौगिकों के विभिन्न वर्गों से संबंधित हो सकते हैं, इसलिए वे न केवल भौतिक, बल्कि रासायनिक गुणों में भी भिन्न हो सकते हैं। चित्र में. चित्र 5 यौगिक C 3 H 8 O के लिए तीन आइसोमर्स दिखाता है, उनमें से दो अल्कोहल हैं, और तीसरा ईथर है
चावल। 5. स्थिति आइसोमर्स
अक्सर, स्थितीय आइसोमर्स की संरचना में अंतर इतना स्पष्ट होता है कि उन्हें मानसिक रूप से अंतरिक्ष में संयोजित करना भी आवश्यक नहीं होता है, उदाहरण के लिए, ब्यूटेन या डाइक्लोरोबेंजीन के आइसोमर्स (चित्र 6):
चावल। 6. ब्यूटेन और डाइक्लोरोबेंजीन के आइसोमर्स
कभी-कभी संरचनात्मक आइसोमर्स हाइड्रोकार्बन कंकाल आइसोमेरिज्म और पोजिशनल आइसोमेरिज्म (चित्र 7) की विशेषताओं को जोड़ते हैं।
चावल। 7. दो प्रकार की संरचनात्मक समरूपता का संयोजन
समरूपता के मामलों में, सैद्धांतिक विचार और प्रयोग आपस में जुड़े हुए हैं। यदि विचार-विमर्श से पता चलता है कि आइसोमर्स मौजूद नहीं हो सकते हैं, तो प्रयोगों को भी यही दिखाना चाहिए। यदि गणना एक निश्चित संख्या में आइसोमर्स को इंगित करती है, तो समान संख्या या उनमें से कम प्राप्त किया जा सकता है, लेकिन अधिक नहीं - सभी सैद्धांतिक रूप से गणना किए गए आइसोमर्स प्राप्त नहीं किए जा सकते हैं, क्योंकि प्रस्तावित आइसोमर में अंतर-परमाणु दूरी या बंधन कोण अनुमेय सीमा से बाहर हो सकते हैं। . छह सीएच समूहों (उदाहरण के लिए, बेंजीन) वाले पदार्थ के लिए, 6 आइसोमर्स सैद्धांतिक रूप से संभव हैं (चित्र 8)।
चावल। 8. बेंजीन आइसोमर्स
दिखाए गए आइसोमर्स में से पहले पांच मौजूद हैं (दूसरे, तीसरे, चौथे और पांचवें आइसोमर्स बेंजीन की संरचना स्थापित होने के लगभग 100 साल बाद प्राप्त किए गए थे)। बाद वाला आइसोमर संभवतः कभी प्राप्त नहीं होगा। एक षट्भुज के रूप में प्रस्तुत, इसके बनने की संभावना सबसे कम है, और इसके विरूपण के परिणामस्वरूप एक बेवल प्रिज्म, एक तीन-बिंदु वाला तारा, एक अधूरा पिरामिड और एक डबल पिरामिड (एक अधूरा ऑक्टाहेड्रोन) के रूप में संरचनाएं बनती हैं। इनमें से प्रत्येक विकल्प में या तो आकार में बहुत भिन्न सी-सी बांड या अत्यधिक विकृत बांड कोण होते हैं (चित्र 9):
रासायनिक परिवर्तन जिसके परिणामस्वरूप संरचनात्मक आइसोमर्स एक दूसरे में परिवर्तित हो जाते हैं, आइसोमेराइजेशन कहलाते हैं।
स्टीरियोइसोमेरिज़्म
यह अंतरिक्ष में परमाणुओं की भिन्न-भिन्न व्यवस्था और उनके बीच बंधों के समान क्रम के कारण उत्पन्न होता है।
स्टीरियोइसोमेरिज्म का एक प्रकार सीआईएस-ट्रांस आइसोमेरिज्म है (सीआईएस - अक्षां. एक तरफ, ट्रांस - अक्षां. के माध्यम से, विभिन्न पक्षों पर) एकाधिक बंधन या समतल चक्र वाले यौगिकों में देखा जाता है। एकल बंधन के विपरीत, एकाधिक बंधन अणु के अलग-अलग टुकड़ों को इसके चारों ओर घूमने की अनुमति नहीं देता है। आइसोमर के प्रकार को निर्धारित करने के लिए, दोहरे बंधन के माध्यम से मानसिक रूप से एक विमान खींचा जाता है और फिर इस विमान के सापेक्ष प्रतिस्थापनों को रखने के तरीके का विश्लेषण किया जाता है। यदि समान समूह समतल के एक ही तरफ हैं, तो यह सिस-आइसोमर, यदि विपरीत पक्षों पर - ट्रांस-आइसोमर:
भौतिक और रासायनिक गुण सिस- और ट्रांस-आइसोमर्स कभी-कभी स्पष्ट रूप से भिन्न होते हैं; मैलिक एसिड में, कार्बोक्सिल समूह -COOH स्थानिक रूप से करीब होते हैं, वे प्रतिक्रिया कर सकते हैं (चित्र 11), मैलिक एसिड एनहाइड्राइड बनाते हैं (यह प्रतिक्रिया फ्यूमरिक एसिड के लिए नहीं होती है):
चावल। 11. मैलिक एनहाइड्राइड का निर्माण
समतल चक्रीय अणुओं के मामले में, मानसिक रूप से एक विमान बनाना आवश्यक नहीं है, क्योंकि यह पहले से ही अणु के आकार द्वारा दिया गया है, उदाहरण के लिए, चक्रीय सिलोक्सेन में (चित्र 12):
चावल। 12. साइक्लोसिलोक्सेन के आइसोमर्स
जटिल धातु यौगिकों में सिस-आइसोमर एक यौगिक है जिसमें धातु के आसपास के दो समान समूह, पास-पास स्थित होते हैं ट्रांस-आइसोमर, वे अन्य समूहों द्वारा अलग किए जाते हैं (चित्र 13):
चावल। 13. कोबाल्ट कॉम्प्लेक्स के आइसोमर्स
दूसरे प्रकार का स्टीरियोइसोमेरिज्म, ऑप्टिकल आइसोमेरिज्म, उन मामलों में होता है जहां दो आइसोमर्स (पहले तैयार की गई परिभाषा के अनुसार, दो अणु जो अंतरिक्ष में संगत नहीं हैं) एक दूसरे की दर्पण छवियां हैं। यह गुण अणुओं में होता है जिन्हें चार अलग-अलग प्रतिस्थापन वाले एकल कार्बन परमाणु के रूप में दर्शाया जा सकता है। चार प्रतिस्थापनों से बंधे केंद्रीय कार्बन परमाणु की संयोजकताएं एक मानसिक टेट्राहेड्रोन के शीर्ष की ओर निर्देशित होती हैं - एक नियमित टेट्राहेड्रोन ( सेमी।कक्षीय) और कठोरता से स्थिर। चित्र में चार असमान प्रतिस्थापन दिखाए गए हैं। विभिन्न रंगों वाली चार गेंदों के रूप में 14:
चावल। 14. चार अलग-अलग पदार्थों वाला कार्बन परमाणु
एक ऑप्टिकल आइसोमर के संभावित गठन का पता लगाने के लिए, अणु को दर्पण में प्रतिबिंबित करना आवश्यक है (चित्र 15), फिर दर्पण छवि को वास्तविक अणु के रूप में लिया जाना चाहिए, मूल अणु के नीचे रखा जाना चाहिए ताकि उनकी ऊर्ध्वाधर अक्ष मेल खाएं, और दूसरे अणु को ऊर्ध्वाधर अक्ष के चारों ओर घुमाया जाना चाहिए ताकि लाल गेंद के ऊपरी और निचले अणु एक दूसरे के नीचे स्थित हों। परिणामस्वरूप, केवल दो गेंदों, बेज और लाल की स्थिति मेल खाती है (दोहरे तीरों द्वारा चिह्नित)। यदि आप निचले अणु को घुमाते हैं ताकि नीली गेंदें संरेखित हो जाएं, तो केवल दो गेंदों की स्थिति फिर से मेल खाएगी - बेज और नीली (दोहरे तीरों से भी चिह्नित)। सब कुछ स्पष्ट हो जाता है यदि इन दो अणुओं को मानसिक रूप से अंतरिक्ष में जोड़ दिया जाए, एक को दूसरे में डाल दिया जाए, जैसे म्यान में चाकू, लाल और हरी गेंद मेल नहीं खाती:
अंतरिक्ष में किसी भी पारस्परिक अभिविन्यास के लिए, परिभाषा के अनुसार ऐसे दो अणु संयुक्त होने पर पूर्ण संयोग प्राप्त नहीं कर सकते हैं; यह ध्यान रखना महत्वपूर्ण है कि यदि केंद्रीय कार्बन परमाणु में चार नहीं, बल्कि केवल तीन अलग-अलग पदार्थ हैं (अर्थात, उनमें से दो समान हैं), तो जब ऐसा अणु दर्पण में परिलक्षित होता है, तो एक ऑप्टिकल आइसोमर नहीं बनता है, चूंकि अणु और उसके प्रतिबिंब को अंतरिक्ष में जोड़ा जा सकता है (चित्र 16):
कार्बन के अलावा, अन्य परमाणु जिनमें सहसंयोजक बंधन टेट्राहेड्रोन के कोनों की ओर निर्देशित होते हैं, उदाहरण के लिए, सिलिकॉन, टिन, फास्फोरस, असममित केंद्र के रूप में कार्य कर सकते हैं।
ऑप्टिकल आइसोमेरिज्म न केवल एक असममित परमाणु के मामले में होता है, बल्कि इसे कुछ निश्चित संख्या में विभिन्न प्रतिस्थापनों की उपस्थिति में कुछ ढांचे के अणुओं में भी महसूस किया जाता है। उदाहरण के लिए, फ्रेमवर्क हाइड्रोकार्बन एडामेंटेन, जिसमें चार अलग-अलग पदार्थ होते हैं (चित्र 17), में एक ऑप्टिकल आइसोमर हो सकता है, जिसमें पूरा अणु एक असममित केंद्र की भूमिका निभाता है, जो स्पष्ट हो जाता है यदि एडामेंटेन फ्रेमवर्क मानसिक रूप से एक बिंदु पर अनुबंधित होता है . इसी प्रकार, सिलोक्सेन, जिसकी घन संरचना है (चित्र 17), भी चार अलग-अलग प्रतिस्थापनों के मामले में ऑप्टिकली सक्रिय हो जाता है:
चावल। 17. प्रकाशिक रूप से सक्रिय मचान अणु
विकल्प तब संभव होते हैं जब अणु में एक असममित केंद्र नहीं होता है, यहां तक कि एक छिपे हुए रूप में भी, लेकिन स्वयं आम तौर पर असममित हो सकता है, और ऑप्टिकल आइसोमर्स भी संभव हैं। उदाहरण के लिए, एक बेरिलियम जटिल यौगिक में, दो चक्रीय टुकड़े परस्पर लंबवत विमानों में स्थित होते हैं, इस मामले में, दो अलग-अलग प्रतिस्थापन एक ऑप्टिकल आइसोमर (छवि 18) प्राप्त करने के लिए पर्याप्त हैं। एक फेरोसीन अणु के लिए, जिसमें एक पेंटाहेड्रल प्रिज्म का आकार होता है, एक ही उद्देश्य के लिए तीन प्रतिस्थापनों की आवश्यकता होती है; इस मामले में हाइड्रोजन परमाणु एक प्रतिस्थापन की भूमिका निभाता है (चित्र 18):
चावल। 18. असममित अणुओं का ऑप्टिकल समावयवता
ज्यादातर मामलों में, किसी यौगिक का संरचनात्मक सूत्र हमें यह समझने की अनुमति देता है कि पदार्थ को ऑप्टिकली सक्रिय बनाने के लिए वास्तव में इसमें क्या बदलाव करने की आवश्यकता है।
वैकल्पिक रूप से सक्रिय स्टीरियोइसोमर्स के संश्लेषण आमतौर पर डेक्सट्रो- और लेवरोटेटरी यौगिकों का मिश्रण उत्पन्न करते हैं। आइसोमर्स का पृथक्करण एक असममित प्रतिक्रिया केंद्र वाले अभिकर्मकों (आमतौर पर प्राकृतिक मूल के) के साथ आइसोमर्स के मिश्रण पर प्रतिक्रिया करके किया जाता है। बैक्टीरिया सहित कुछ जीवित जीव, लेवरोटेटरी आइसोमर्स को प्राथमिकता से चयापचय करते हैं।
प्रक्रियाएं (जिन्हें असममित संश्लेषण कहा जाता है) अब विशेष रूप से एक विशिष्ट ऑप्टिकल आइसोमर का उत्पादन करने के लिए विकसित की गई हैं।
ऐसी प्रतिक्रियाएं हैं जो आपको एक ऑप्टिकल आइसोमर को उसके एंटीपोड में बदलने की अनुमति देती हैं ( सेमी. वाल्डेन रूपांतरण).
मिखाइल लेवित्स्की