Dans la leçon 13 "" du cours " Chimie pour les nuls» réfléchir à la raison pour laquelle des équations chimiques sont nécessaires ; Apprenons à égaliser les réactions chimiques en disposant correctement les coefficients. Cette leçon vous demandera de connaître la chimie de base des leçons précédentes. Assurez-vous de lire sur l'analyse élémentaire pour un examen approfondi des formules empiriques et de l'analyse chimique.
À la suite de la réaction de combustion du méthane CH 4 dans l'oxygène O 2, du dioxyde de carbone CO 2 et de l'eau H 2 O se forment. Cette réaction peut être décrite. équation chimique:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Essayons d'extraire plus d'informations d'une équation chimique qu'une simple indication produits et réactifs réactions. L'équation chimique (1) est INcomplète et ne fournit donc aucune information sur le nombre de molécules d'O 2 consommées pour 1 molécule de CH 4 et sur le nombre de molécules de CO 2 et H2 O obtenues en conséquence. Mais si nous écrivons des coefficients numériques devant les formules moléculaires correspondantes, qui indiquent combien de molécules de chaque type participent à la réaction, alors nous obtenons équation chimique complète réactions.
Afin de compléter la composition de l'équation chimique (1), vous devez vous rappeler une règle simple : les côtés gauche et droit de l'équation doivent contenir le même nombre d'atomes de chaque type, car lors de la réaction chimique, aucun nouvel atome n'est formé. ceux créés et existants ne sont pas détruits. Cette règle est basée sur la loi de conservation de la masse, dont nous avons parlé au début du chapitre.
C'est nécessaire pour en obtenir une complète à partir d'une simple équation chimique. Passons donc à l’équation de réaction (1) : jetez un autre regard à l’équation chimique, exactement aux atomes et aux molécules des côtés droit et gauche. Il est facile de voir que la réaction implique trois types d'atomes : le carbone C, l'hydrogène H et l'oxygène O. Comptons et comparons le nombre d'atomes de chaque type sur les côtés droit et gauche de l'équation chimique.

Commençons par le carbone. Sur le côté gauche, un atome de C fait partie de la molécule CH 4 et sur le côté droit, un atome de C fait partie de CO 2. Ainsi, sur les côtés gauche et droit, le nombre d’atomes de carbone est le même, donc nous le laissons tranquille. Mais pour plus de clarté, mettons un coefficient de 1 devant les molécules avec du carbone, bien que ce ne soit pas nécessaire :
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Ensuite, nous passons au comptage des atomes d'hydrogène H. Sur le côté gauche, il y a 4 atomes H (au sens quantitatif, H 4 = 4H) dans la molécule CH 4, et sur le côté droit, il n'y a que 2 atomes H dans la molécule. Molécule H 2 O, qui est deux fois inférieure à celle du côté gauche de l'équation chimique (2). Égalisons ! Pour ce faire, mettons un coefficient de 2 devant la molécule H 2 O. Nous aurons maintenant 4 molécules d'hydrogène H à la fois dans les réactifs et dans les produits :
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Veuillez noter que le coefficient 2, que nous avons écrit devant la molécule d'eau H 2 O pour égaliser l'hydrogène H, augmente de 2 fois tous les atomes qui le composent, c'est-à-dire 2H 2 O signifie 4H et 2O. Bon, il semble que nous ayons réglé ce problème, il ne reste plus qu'à compter et comparer le nombre d'atomes d'oxygène O dans l'équation chimique (3). On remarque immédiatement qu’il y a exactement 2 fois moins d’atomes d’oxygène du côté gauche que du côté droit. Maintenant que vous savez déjà comment équilibrer vous-même les équations chimiques, je vais donc immédiatement écrire le résultat final :
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O ou CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Comme vous pouvez le constater, l'égalisation des réactions chimiques n'est pas une chose si délicate, et ce n'est pas la chimie qui est importante ici, mais les mathématiques. L'équation (4) est appelée équation complète réaction chimique, car elle obéit à la loi de conservation de la masse, c'est-à-dire le nombre d'atomes de chaque type qui entrent dans la réaction coïncide exactement avec le nombre d'atomes de ce type à la fin de la réaction. Chaque côté de cette équation chimique complète contient 1 atome de carbone, 4 atomes d'hydrogène et 4 atomes d'oxygène. Cependant, il convient de comprendre quelques points importants : une réaction chimique est une séquence complexe d'étapes intermédiaires individuelles et, par conséquent, par exemple, l'équation (4) ne peut pas être interprétée dans le sens où 1 molécule de méthane doit simultanément entrer en collision avec 2 molécules d'oxygène. molécules. Les processus se produisant lors de la formation des produits de réaction sont beaucoup plus complexes. Deuxième point : l'équation complète d'une réaction ne nous dit rien sur son mécanisme moléculaire, c'est-à-dire sur la séquence d'événements qui se produisent au niveau moléculaire lors de son apparition.
Coefficients dans les équations de réactions chimiques
Un autre exemple clair de la façon d'organiser correctement chances dans les équations de réactions chimiques : le trinitrotoluène (TNT) C 7 H 5 N 3 O 6 se combine vigoureusement avec l'oxygène pour former H 2 O, CO 2 et N 2. Écrivons l'équation de réaction que nous égaliserons :
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Il est plus facile de construire l'équation complète basée sur deux molécules de TNT, puisque le côté gauche contient un nombre impair d'atomes d'hydrogène et d'azote, et le côté droit contient un nombre pair :
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Il est alors clair que 14 atomes de carbone, 10 atomes d'hydrogène et 6 atomes d'azote doivent se transformer en 14 molécules de dioxyde de carbone, 5 molécules d'eau et 3 molécules d'azote :
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Désormais, les deux parties contiennent le même nombre d’atomes, à l’exception de l’oxygène. Sur les 33 atomes d'oxygène présents du côté droit de l'équation, 12 sont fournis par les deux molécules de TNT d'origine, et les 21 restants doivent être fournis par 10,5 molécules d'O 2 . Ainsi, l’équation chimique complète ressemblera à :
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Vous pouvez multiplier les deux côtés par 2 et vous débarrasser du coefficient non entier 10,5 :
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Mais cela n’est pas nécessaire, car il n’est pas nécessaire que tous les coefficients de l’équation soient des nombres entiers. Il serait encore plus correct de créer une équation basée sur une molécule de TNT :
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
L'équation chimique complète (9) contient de nombreuses informations. Tout d'abord, il indique les substances de départ - réactifs, et des produits réactions. De plus, cela montre que lors de la réaction, tous les atomes de chaque type sont préservés individuellement. Si l'on multiplie les deux côtés de l'équation (9) par le nombre d'Avogadro N A = 6,022 10 23, on peut affirmer que 4 moles de TNT réagissent avec 21 moles d'O 2 pour former 28 moles de CO 2, 10 moles de H 2 O et 6 moles de N 2.
Il y a encore une astuce. À l'aide du tableau périodique, nous déterminons les masses moléculaires de toutes ces substances :
- C 7 H 5 N 3 O 6 = 227,13 g/mol
- O2 = 31,999 g/mole
- CO2 = 44,010 g/mole
- H2O = 18,015 g/mole
- N2 = 28,013 g/mole
Maintenant, l'équation 9 indiquera également que 4 227,13 g = 908,52 g de TNT nécessitent 21 31,999 g = 671,98 g d'oxygène pour terminer la réaction et, par conséquent, 28 44,010 g = 1232,3 g de CO 2 sont formés, 10·18,015 g = 180,15. g H2O et 6·28,013 g = 168,08 g N2. Vérifions si la loi de conservation de la masse est satisfaite dans cette réaction :
| Réactifs | Des produits | |
| 908,52 g de TNT | 1232,3 g de CO2 | |
| 671,98 g de CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Total | 1580,5 g | 1580,5 g |
Mais les molécules individuelles ne doivent pas nécessairement participer à une réaction chimique. Par exemple, la réaction du calcaire CaCO3 et de l'acide chlorhydrique HCl pour former une solution aqueuse de chlorure de calcium CaCl2 et de dioxyde de carbone CO2 :
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
L'équation chimique (11) décrit la réaction du carbonate de calcium CaCO 3 (calcaire) et de l'acide chlorhydrique HCl pour former une solution aqueuse de chlorure de calcium CaCl 2 et de dioxyde de carbone CO 2. Cette équation est complète puisque le nombre d’atomes de chaque type sur ses côtés gauche et droit est le même.
La signification de cette équation est niveau macroscopique (molaire) est la suivante : 1 mole ou 100,09 g de CaCO 3 nécessite 2 moles ou 72,92 g de HCl pour terminer la réaction, ce qui donne 1 mole de CaCl 2 (110,99 g/mol), CO 2 (44,01 g /mol) et H 2 O (18,02 g/mol). A partir de ces données numériques, il est facile de vérifier que la loi de conservation de la masse est satisfaite dans cette réaction.
Interprétation de l'équation (11) sur niveau microscopique (moléculaire) n'est pas si évident, puisque le carbonate de calcium est un sel, pas un composé moléculaire, et donc l'équation chimique (11) ne peut pas être comprise dans le sens où 1 molécule de carbonate de calcium CaCO 3 réagit avec 2 molécules de HCl. De plus, la molécule HCl en solution se dissocie (se désintègre) généralement en ions H + et Cl -. Ainsi, une description plus correcte de ce qui se passe dans cette réaction au niveau moléculaire est donnée par l'équation :
- CaCO 3 (sol.) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
Ici, l'état physique de chaque type de particule est brièvement indiqué entre parenthèses ( la télé- dur, aq.- ion hydraté en solution aqueuse, G.- gaz, et.- liquide).
L'équation (12) montre que le CaCO 3 solide réagit avec deux ions H + hydratés, formant les ions positifs Ca 2+, CO 2 et H 2 O. L'équation (12), comme d'autres équations chimiques complètes, ne fournit pas d'informations sur la structure moléculaire. mécanisme réactions et est moins pratique pour compter la quantité de substances, cependant, il donne une meilleure description de ce qui se passe au niveau microscopique.
Renforcez vos connaissances sur la composition d'équations chimiques en travaillant vous-même sur un exemple avec une solution :
J'espère à partir de la leçon 13" Écrire des équations chimiques"Vous avez appris quelque chose de nouveau par vous-même. Si vous avez des questions, écrivez-les dans les commentaires.
Algorithme
Disposition des coefficients dans les équations de réactions chimiques
Professeur de chimie lycée MBOU n°2
Volodchenko Svetlana Nikolaïevna
Oussouriisk
DISPOSITION DES COEFFICIENTS DANS LES ÉQUATIONS DE RÉACTIONS CHIMIQUES
Le nombre d’atomes d’un élément du côté gauche de l’équation doit être égal au nombre d’atomes de cet élément du côté droit de l’équation.
Tâche 1 (pour les groupes).Déterminez le nombre d’atomes de chaque élément chimique participant à la réaction.
1. Calculez le nombre d’atomes :
UN) hydrogène: 8NH3, NaOH, 6NaOH, 2NaOH,NZRO4, 2H2SO4, 3H2S04, 8H2SO4;
6) oxygène: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Calculez le nombre d'atomes : a)hydrogène:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) oxygène :
1) 2СО + 02 2) С02 + 2Н.О. 3)4NO2 + 2H2O + O2
Algorithme pour organiser les coefficients dans les équations de réactions chimiques
А1 + О2→ А12О3A1-1 atome A1-2
O-2 atome O-3
2. Parmi les éléments avec des nombres d'atomes différents dans les parties gauche et droite du diagramme, choisissez celui dont le nombre d'atomes est le plus grand.
Atomes O-2 à gauche
Atomes O-3 à droite
3. Trouvez le plus petit commun multiple (LCM) du nombre d'atomes de cet élément du côté gauche de l'équation et du nombre d'atomes de cet élément du côté droit de l'équation
LCM = 6
4. Divisez le LCM par le nombre d'atomes de cet élément du côté gauche de l'équation, obtenez le coefficient pour le côté gauche de l'équation
6:2 = 3
Al + ZO 2 →Al 2 À PROPOS 3
5. Divisez le LCM par le nombre d'atomes de cet élément du côté droit de l'équation, obtenez le coefficient du côté droit de l'équation
6:3 = 2
A1+O 2 →2A1 2 O3
6. Si le coefficient défini a modifié le nombre d'atomes d'un autre élément, répétez à nouveau les étapes 3, 4, 5.
A1 + ZO 2 → →2А1 2 À PROPOS 3
A1 -1 atome A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → →2A1 2 À PROPOS 3
. Test primaire d'acquisition de connaissances (8-10 min .).
Il y a deux atomes d’oxygène sur le côté gauche du diagramme et un sur la droite. Le nombre d'atomes doit être égalisé à l'aide de coefficients.
1)2Mg+O2 →2MgO
2) CaCO3 + 2HCl → CaCl2 +N2 O + CO2
Tâche 2 Placez les coefficients dans les équations des réactions chimiques (notez que le coefficient modifie le nombre d'atomes d'un seul élément):
1. Fe 2 Ô 3 + Un je → UN je 2 À PROPOS 3 + Fe ; Mg+N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1+ AVEC → Al 4 C 3 ;
3. Al + Cr 2 Ô 3 → Cr+Al 2 Ô 3 ; Ca + P → Californie 3 P. 2 ;
4.C+ H 2 → CH 4 ; Californie +C → SaS 2 ;
5. Fe + O 2 → Fe 3 Ô 4 ; Si + Mg → Mg 2 Si;
6/.Na+S → N / A 2 S ; CaO+ AVEC → CaC 2 + CO ;
7.Ca+N 2 → C un 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S ; N 2 + AVEC je 2 → N.-É. je;
9.N 2 + O 2 → NON; CO 2 + AVEC → CO ;
10. SALUT → N 2 → + 1 2 ; Mg+ N.-É. je → MgCl 2 + N 2 ;
11.FeS+ N.-É. 1 → FeCl 2 +H 2 S ; Zn+HCl → ZnCl 2 +H 2 ;
12. Frère 2 +KI → KBr+I 2 ; Si+HF (r) → SiF 4 +H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+NaCl; KClO 3 +S → → KCl+SO 2 ;
14. Classe 2 + KBr → KCl + Br 2 ; SiO 2 + AVEC → Si + CO ;
15. SiO 2 + AVEC → SiC + CO ; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Quelle est l’équation d’une réaction chimique ?
2.Qu'est-ce qui est écrit sur le côté droit de l'équation ? Et à gauche ?
3. Que signifie le signe « + » dans une équation ?
4. Pourquoi les coefficients sont-ils placés dans les équations chimiques ?
Il existe plusieurs méthodes pour déterminer les coefficients dans les équations des réactions redox. Nous utilisons la méthode de la balance électronique, dans laquelle la compilation de l'équation OVR complète est effectuée dans l'ordre suivant :
1. Etablissez un diagramme de réaction, indiquant les substances qui ont réagi et les substances résultant de la réaction, par exemple :
2. Déterminez l'état d'oxydation des atomes et écrivez son signe et sa valeur au-dessus des symboles des éléments, en notant les éléments dont l'état d'oxydation a changé :
3. Notez les équations électroniques des réactions d'oxydation et de réduction, déterminez le nombre d'électrons donnés par l'agent réducteur et acceptés par l'agent oxydant, puis égalisez-les en les multipliant par les coefficients appropriés :
4. Les coefficients obtenus correspondant à la balance électronique sont transférés à l'équation principale :
5. Égalisez le nombre d'atomes et d'ions qui ne changent pas l'état d'oxydation (dans l'ordre : métaux, non-métaux, hydrogène) :
6. Vérifiez l'exactitude de la sélection des coefficients basés sur le nombre d'atomes d'oxygène sur les côtés gauche et droit de l'équation de réaction - ils doivent être égaux (dans cette équation 24 = 18 + 2 + 4, 24 = 24).
Regardons un exemple plus complexe :
Déterminons les états d'oxydation des atomes dans les molécules :
Créons des équations électroniques pour les réactions d'oxydation et de réduction et égalisons le nombre d'électrons donnés et acceptés :
Transférons les coefficients à l'équation principale :
Égalisons le nombre d'atomes qui ne changent pas l'état d'oxydation :
En comptant le nombre d'atomes d'oxygène sur les côtés droit et gauche de l'équation, nous nous assurerons que les coefficients sont choisis correctement.
Les agents oxydants et réducteurs les plus importants
Les propriétés rédox des éléments dépendent de la structure de la coque électronique des atomes et sont déterminées par leur position dans le tableau périodique de Mendeleïev.
Les métaux, ayant 1 à 3 électrons au niveau d'énergie externe, les abandonnent facilement et ne présentent que des propriétés réductrices. Les non-métaux (éléments des groupes IV-VII) peuvent à la fois donner et accepter des électrons, ils peuvent donc présenter des propriétés à la fois réductrices et oxydantes. Dans les périodes d'augmentation du numéro atomique d'un élément, les propriétés réductrices des substances simples s'affaiblissent et les propriétés oxydantes augmentent. Dans les groupes avec une augmentation du nombre ordinal, les propriétés réductrices augmentent et les propriétés oxydantes s'affaiblissent. Ainsi, parmi les substances simples, les meilleurs agents réducteurs sont les métaux alcalins, l'aluminium, l'hydrogène, le carbone ; les meilleurs agents oxydants sont les halogènes et l'oxygène.
Les propriétés rédox des substances complexes dépendent du degré d'oxydation des atomes qui les composent. Les substances contenant des atomes avec le degré d'oxydation le plus bas présentent des propriétés réductrices. Les agents réducteurs les plus importants sont le monoxyde de carbone  , sulfure d'hydrogène
, sulfure d'hydrogène  , sulfate de fer(II)
, sulfate de fer(II)  .Les substances contenant des atomes avec l'état d'oxydation le plus élevé présentent des propriétés oxydantes. Les agents oxydants les plus importants sont le permanganate de potassium
.Les substances contenant des atomes avec l'état d'oxydation le plus élevé présentent des propriétés oxydantes. Les agents oxydants les plus importants sont le permanganate de potassium  , dichromate de potassium
, dichromate de potassium  , peroxyde d'hydrogène
, peroxyde d'hydrogène  , Acide nitrique
, Acide nitrique  , acide sulfurique concentré
, acide sulfurique concentré  .
.
Les substances contenant des atomes avec des états d'oxydation intermédiaires peuvent se comporter comme des agents oxydants ou réducteurs en fonction des propriétés des substances avec lesquelles ils interagissent et des conditions de réaction. Donc en réaction avec  l'acide sulfureux présente des propriétés réductrices :
l'acide sulfureux présente des propriétés réductrices :
et lorsqu'il interagit avec le sulfure d'hydrogène, c'est un agent oxydant :

De plus, pour de telles substances, des réactions d'auto-oxydation-auto-réduction sont possibles, se produisant avec une augmentation et une diminution simultanées de l'état d'oxydation des atomes du même élément, par exemple :
La force de nombreux agents oxydants et réducteurs dépend du pH du milieu. Par exemple, 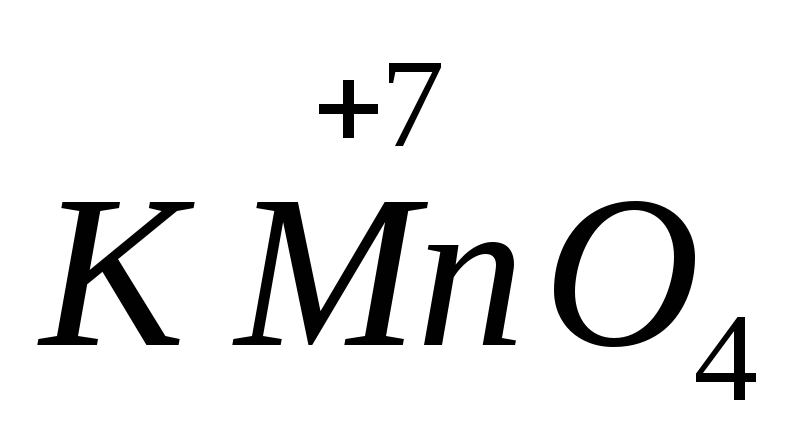 dans un environnement alcalin, il est réduit à
dans un environnement alcalin, il est réduit à  , au neutre pour
, au neutre pour  , en présence d'acide sulfurique - jusqu'à
, en présence d'acide sulfurique - jusqu'à  .
.
L  Est-il facile de placer des coefficients dans des équations chimiques ?
Est-il facile de placer des coefficients dans des équations chimiques ?
Mes enfants ont donc grandi avec la chimie (je suis le professeur de la 8e année « B »). La chimie est le plus souvent enseignée aux enfants lors du premier cours, mais jeudi, je n'ai pas eu le premier cours et j'ai demandé à aller au cours de Valentina Ivanovna pour « regarder les enfants » et vérifier les journaux. Le sujet me fascinait ; à l’école, j’adorais la chimie et je ne consultais pas les agendas. Encore une fois, j'étais convaincu que les étudiants éprouvent le plus souvent des difficultés dues au fait qu'ils ne voient pas les liens interdisciplinaires. Dans cette leçon de chimie, les élèves devaient créer des équations chimiques en connaissant la valence des produits chimiques. Et de nombreux étudiants ont eu du mal à déterminer des coefficients numériques. Valentina Ivanovna et moi avons eu notre prochain cours de chimie ensemble samedi.
Exercice 1.
Écrivez les phrases suivantes sous forme d’équations chimiques :
A) « Lorsque le carbonate de calcium est cuit, de l'oxyde de calcium et du monoxyde de carbone (IV) se forment » ; b) «Lorsque l'oxyde de phosphore (V) réagit avec l'eau, on obtient de l'acide phosphorique.»
Solution:
A) CaCO 3 = CaO + CO 2 - la réaction est endothermique. Cette tâche n’a posé aucune difficulté, puisqu’il n’était pas nécessaire de rechercher des coefficients numériques. Initialement, les côtés gauche et droit de l’équation contiennent un atome de calcium, un atome de carbone et trois atomes d’oxygène.
B) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - la réaction est exothermique. Il y avait des problèmes avec la deuxième équation ; sans coefficients numériques, l'égalité correcte n'a pas fonctionné : P 2 O 5 + H 2 O → H 3 PO 4 . Évidemment, pour établir une égalité correcte, il faut sélectionner des coefficients numériques. Si vous sélectionnez, vous pouvez commencer par le phosphore : il y a deux atomes à gauche, et un à droite, donc avant la formule de l'acide nitrique on met un facteur numérique égal à deux et on obtient alors : P 2 O 5 + H 2 O → 2H 3 PO 4 . Mais maintenant il reste à égaliser le nombre d'atomes d'oxygène et d'hydrogène : il y a deux atomes d'hydrogène à gauche, et six atomes à droite, donc avant la formule de l'eau on met un coefficient numérique égal à trois et on obtient alors : P 2 O 5 + 3H 2 O → 2H 3 PO 4. Maintenant, il est facile de vérifier que dans chaque partie de l'équation il y a des quantités égales d'atomes de phosphore, d'atomes d'hydrogène et d'atomes d'oxygène, nous avons donc obtenu l'équation correcte de la réaction chimique : P 2 O 5 + 3H 2 O = 2H 3 ON 4.
Deuxième manière : algébrique. Supposons que nous mettions trois coefficients dans l'équation une, b, c , que l'équation correcte de la réaction chimique a été obtenue : UN P2O5+ V H2O= Avec H3PO4. Puisque l’équation utilise trois types d’atomes, nous allons créer un système de trois équations linéaires à trois inconnues un, c Et Avec .
Substances utilisées dans la réaction chimique : P – phosphore ; O 2 – oxygène ; P 2 O 5 – oxyde de phosphore (V).
B) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
Substances utilisées dans la réaction chimique : Fe 2 (SO 4) 3 – sulfate de fer (III) ; KOH – hydroxyde de potassium ; Fe(OH) 3 – hydroxyde de fer (III); K 2 SO 4 – sulfate de potassium.
D) CuOH → Cu 2 O + H 2 O.
Solution: 2CuOH = Cu 2 O + H 2 O. Le problème de la détermination des coefficients numériques a été résolu en composant un système d'équations : 
Substances utilisées dans la réaction chimique : CuOH – hydroxyde de cuivre (I) ; Cu 2 O – oxyde de cuivre (I); H 2 O – eau.
D) CS 2 + O 2 → CO 2 + SO 2.
Solution: CS2 + 3O2 = CO2 + 2SO2. Nous avons résolu en sélectionnant des coefficients : nous avons égalisé le nombre d'atomes de soufre (2) ; égalisé le nombre d'atomes d'oxygène (3).
Substances utilisées dans la réaction chimique : CS 2 – sulfure de soufre (IV) ; Ô2 –
Substances utilisées dans la réaction chimique : FeS 2 – pyrite ; O 2 – oxygène ; Fe 2 O 3 – oxyde de fer (III); SO 2 - oxyde de soufre (IV).
Exercice 3.
(Il a été proposé pour solution dans le cadre d'un travail distinct).
Condition:
Écrivez les équations des réactions chimiques selon les schémas suivants :
A) acide phosphorique + hydroxyde de sodium → phosphate de sodium + eau ;
B) oxyde de sodium + eau → hydroxyde de sodium ;
B) oxyde de fer (II) + aluminium → oxyde d'aluminium + fer ;
D) hydroxyde de cuivre (II) → oxyde de cuivre (II) + eau.
Répondre:
A) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O ;
B) Na 2 O + H 2 O = 2NaOH ;
B) 3FeO + 2Al = Al 2 O 3 + 3Fe ;
D) Cu(OH) 2 = CuO + H 2 O.
En 10 minutes, 85 % des étudiants ont accompli la tâche « parfaitement », ce qui a agréablement surpris Valentina Ivanovna.
L'équation de réaction la plus simple est :
Fe + S => FeS
Vous devez être capable non seulement d’écrire l’équation de réaction, mais aussi de la lire. Cette équation, dans sa forme la plus simple, se lit comme suit : une molécule de fer interagit avec une molécule de soufre, ce qui donne une molécule de sulfure de fer.
La chose la plus difficile dans l'écriture d'une équation de réaction est de créer des formules pour les produits de réaction, c'est-à-dire substances formées. Il n'y a ici qu'une seule règle : les formules des molécules sont construites strictement en fonction de la valence de leurs éléments constitutifs.
De plus, lors de la composition des équations de réaction, il faut se rappeler la loi de conservation de la masse des substances : tous les atomes des molécules des substances de départ doivent être inclus dans les molécules des produits de réaction. Pas un seul atome ne devrait disparaître ou apparaître de manière inattendue. Par conséquent, parfois, après avoir écrit toutes les formules de l'équation de réaction, vous devez égaliser le nombre d'atomes dans chaque partie de l'équation - définir les coefficients. Voici un exemple :
C + O2 => CO2Ici, chaque élément a le même nombre d’atomes à droite et à gauche de l’équation. L'équation est prête.
Cu+O 2 => CuO
Et ici, il y a plus d’atomes d’oxygène du côté gauche de l’équation que du côté droit. Il faut obtenir autant de molécules d'oxyde de cuivre
CuO , afin qu'ils contiennent le même nombre d'atomes d'oxygène, soit 2. Par conséquent, la formuleCuO définir le coefficient 2 :Cu+O2 => 2 CuO
Or, le nombre d’atomes de cuivre n’est plus le même. Sur le côté gauche de l'équation, avant le signe du cuivre on met le coefficient 2 :
2 Cu + O2 => 2 CuO
Comptez s'il y a un nombre égal d'atomes de chaque élément sur les côtés gauche et droit de l'équation. Si oui, alors l’équation de réaction est correcte.
Encore un exemple : Al+O 2 = Al 2 Ô 3
Et ici, il y a différents nombres d'atomes de chaque élément avant et après la réaction. Nous commençons le nivellement avec du gaz - avec des molécules d'oxygène :
1) Gauche 2 atomes d'oxygène, et à droite 3. On recherche le plus petit commun multiple de ces deux nombres. Il s'agit du plus petit nombre divisible par 2 et par 3, soit 6. Avant les formules d'oxygène et d'oxyde d'aluminiumAl 2 Ô 3 Nous définissons de tels coefficients de sorte que le nombre total d'atomes d'oxygène dans ces molécules soit de 6 :
Al+ 3O2= 2Al2O 3
2) On compte le nombre d'atomes d'aluminium : à gauche il y a 1 atome, et à droite il y a 2 atomes dans deux molécules, soit 4. Avant le signe en aluminium sur le côté gauche de l'équation on met le coefficient 4 :
4Al + 3O 2 => 2 Al2O3
3) Encore une fois, on compte tous les atomes avant et après la réaction : 4 atomes d’aluminium et 6 atomes d’oxygène chacun.
Tout est en ordre, l'équation de réaction est correcte. Et si la réaction se produit lorsqu'elle est chauffée, alors un signe supplémentaire est placé au-dessus de la flèche t.
L'équation d'une réaction chimique est un enregistrement de la progression d'une réaction chimique à l'aide de formules chimiques et de coefficients.






