U ovom članku će se raspravljati o metodama za određivanje aminokiselina koje se koriste ne samo u analizi proizvoda, već iu biohemiji i farmaceutskoj analizi.
Ukupna količina aminokiselina može se odrediti fotometrijskom metodom na osnovu određivanja amonijaka dobijenog iz aminokiselina Kjeldahlovom metodom.
Reakcija sa 1-naftolom. Za određivanje arginina, histidina i tirozina predložena je reakcija s 1-naftolom. U prisustvu natrijum hipohlorita (NaOCl), rastvor postaje crven. Rastvor uzorka u 50% etanolu koji sadrži aminokiselinu se ohladi ledom i dodaju 10% rastvor NaOCl i rastvor naftola. Produkt reakcije je obojen crveno (l max = 550 nm). Sadržaj aminokiselina određen je intenzitetom boje dobivene otopine.
Biuret reakcija. Jedna od najvažnijih reakcija koja se koristi za određivanje aminokiselina je biuret reakcija. Reakcija se izvodi dodavanjem razrijeđenog biureta u alkalni rastvor vodeni rastvor soli bakra(II). U ovom slučaju, otopina postaje intenzivno ljubičasta zbog stvaranja kompleksnog spoja.

Reakcija biureta uključuje spojeve koji sadrže najmanje 2 amidne grupe ili aminohidroksietilensku grupu, kao i amide i imide aminokiselina. Ovu reakciju provode proteini i koncentrirani rastvori aminokiselina i amida. Razrijeđene otopine aminokiselina ne daju biuretnu reakciju i stoga se reakcija može koristiti za određivanje kraja hidrolize proteina. Reakcija se također koristi za kvalitativno i kvantitativno određivanje proteina. Biuret reakcija je osnova za metode koje se koriste u kliničko-dijagnostičkim laboratorijama za određivanje proteina u krvi i drugim biološkim tekućinama.
Ninhidrinska reakcija. Druga najvažnija reakcija koja se koristi za određivanje aminokiselina je reakcija ninhidrina - reakcija boje na a-aminokiseline, koja se provodi zagrijavanjem potonjih u alkalni rastvor višak ninhidrina.
Ninhidrin vrši oksidativnu dekarboksilaciju a-aminokiselina sa stvaranjem amonijaka, ugljen-dioksid i aldehid koji sadrži jedan atom ugljika manje od matične aminokiseline. Redukovani ninhidrin dalje reaguje sa oslobođenim amonijakom i drugom molekulom ninhidrina, formirajući obojeni proizvod kondenzacije sa amonijakom.

Dobijeni spoj (pigment) ima ljubičasto-plavu boju (l max = 570 nm). Formiranje ovog obojenog spoja koristi se u kvantitativnom testu a-aminokiselina, koji može otkriti aminokiseline čak i u količinama od samo 1 µg.
Prolin i hidroksiprolin, koji nemaju a-amino grupu, reaguju sa ninhidrinom i formiraju derivate žuta boja(l max = 440 nm). Reakcija nije specifična, jer amonijak i jedinjenja koja sadrže amino grupu (amini, proteini, peptidi) takođe proizvode obojeni proizvod sa ninhidrinom. Međutim, sa ovim jedinjenjima se CO 2 ne oslobađa. Oslobađanje ugljičnog dioksida karakteristično je samo za a-aminokiseline. Reakcija se koristi za kolorimetrijsko kvantitativno određivanje a-amino kiselina, uključujući u automatskim analizatorima aminokiselina (mjerenje zapremine CO 2).
Reakcija ninhidrina se koristi za određivanje glicina, izoleucina i leucina; serin, fenilalanin, cistein, tirozin, triptofan itd. daju manje intenzivnu boju.
Dobijeni proizvodi se odlikuju prilično intenzivnom bojom (e = 1,8–3,3·10 4), ali su obojeni proizvodi nestabilni. Intenzitet boje brzo opada. Za stabilizaciju se dodaje CdCl 2. Sa nastalim jedinjenjima formira stabilne komplekse. Kadmijum hlorid takođe ubrzava reakciju.
Aminokiseline i neka druga jedinjenja koja sadrže amino grupu kondenzuju se u alkalnom okruženju sa 1,2-naftokinonom - 4-sulfoksilotom za formiranje crvenih, žutih, narandžastih derivata 1,2-naftokinona monoimina.

Reakcija se koristi za određivanje a-aminoksilata (valin, izoleucin, leucin, itd.).
Za određivanje triptofana može se koristiti reakcija s 4-dimetilaminobenzaldehidom. Produkt reakcije je ljubičasto obojen, a sadržaj triptofana u analiziranoj otopini određen je intenzitetom boje.
Međutim, treba napomenuti da se ova reakcija rijetko koristi u analizi hrane.

Za kvantitativno određivanje aminokiselina koje sadrže sumpor koristi se bromatometrijska metoda zasnovana na sljedećoj reakciji:

Rastvor cisteina u 1% rastvoru NaOH sipa se u tikvicu sa brušenim čepom, doda se 0,1 N. rastvor kalijum bromata, suvi kalijum bromid i zakiseljen sa 10% HCl.
BrO 3 – + 5Br – + 6H + → 3Br 2 + 3H 2 O
Brom nastao kao rezultat reakcije, čija je količina ekvivalentna količini kalijevog bromata, reagira s amino kiselinom. Nakon 10 minuta dodaje se kalijum jodid koji reaguje sa neizreagiranim bromom, a oslobođeni jod titrira se sa 0,1 N. rastvor natrijum tiosulfata sa skrobom kao indikatorom.
2I – + Br 2 → Br - + I 2
Količina tiosulfata koja se koristi za titraciju je ekvivalentna količini broma koji nije reagovao sa amino kiselinom. Na osnovu razlike između količine dodanog kalijevog bromata i tiosulfata, utvrđuje se količina broma koja je ušla u reakciju sa aminokiselinom, a time i količina aminokiseline.
Metionin se određuje slično. Metionin se oksidira u sulfon:
Ova reakcija kada određenim uslovima omogućava vam da vrlo precizno odredite sadržaj metionina.
Metode za određivanje aminokiselina
Aminokiseline su biološki aktivne supstance, igraju veliku ulogu u životu ljudskog tijela, naširoko se koriste kao lijekovi. Neki od njih su neophodni i ulaze u organizam sa hranom. Trenutno postoji niz metoda za kvantitativno određivanje aminokiselina u ljekovitom biljnom materijalu, uključujući lijekovi i biološke tečnosti, u prehrambenim proizvodima.
Od raznovrsnosti metoda za kvantitativno određivanje aminokiselina u različitim objektima mogu se izdvojiti četiri glavne grupe: hromatografske, spektrofotometrijske, titrimetrijske i elektrohemijske metode analize.
Kromatografske metode
Tokom proteklih decenija, napravljen je značajan napredak u oblasti gasno-tečne hromatografije aminokiselina. Predložena je metoda koja koristi mikropakovane kolone, koja omogućava relativno kratko vrijeme razdvajaju gotovo u potpunosti 17 biološki važnih α-amino kiselina.
Razvijena je metoda za određivanje aminokiselina plinsko-tečnom hromatografijom u uzorcima seruma, plazme, urina i cerebrospinalnu tečnost, zasnovan na pripremi 2,3,4,5,6-pentafluorobenzoil-izobutil etera nakon čega slijedi odvajanje na polidimetilsiloksanskoj koloni u režimu programiranja temperature od 140°C do 250°C sa detektorom plamene jonizacije. Vrijeme hromatografskog odvajanja je 28 minuta. Kao rezultat istraživanja izdvojeno je 27 aminokiselina.
Uprkos raznovrsnosti metoda tečne hromatografije visokih performansi za analizu aminokiselina, najbrža i najpristupačnija je verzija reverzne faze sa spektrofotometrijskom detekcijom. Za uspješnu separaciju i detekciju, aminokiseline se pretvaraju u hidrofobne derivate i derivate koji apsorbiraju svjetlost, odnosno vrši se pre-kolona derivatizacija. Ortoftalni aldehid, naftalen-2,3-dikarboksialdehid i 9-fluorenilmetilhloroformat se koriste kao reagensi za derivatizaciju.
Razvijena je metoda za kvantitativno određivanje L-cistina, L-glutaminske kiseline i glicina u lijeku "Eltacin", koji ima antioksidativno djelovanje u kombinaciji sa antianginalnim djelovanjem. Glutaminska kiselina i glicin su određivani tečnom hromatografijom visokih performansi reverzne faze nakon pre-kolone derivatizacije sa reagensom ortoftalni dehid/N-acetil-L-cistein. Derivatizacija cisteina je, prema autorima, teška zbog nestabilnosti same aminokiseline i nastalih derivata. Stoga je analiza cisteina provedena bromatometrijskom titracijom. Utvrđeno je da prisustvo značajnih količina cisteina u uzorku ne ometa određivanje produkata derivatizacije glicina i glutaminske kiseline sa ortoftalnim aldehidom/N-acetil-L-cistein reagensom. Metodu karakteriše visoka ponovljivost i tačnost određivanja.
Mogućnost upotrebe 4,7-fenantrolin-5,6-diona (fankinona) kao fluorogenog reagensa za obeležavanje za pretkolonačko formiranje njegovih derivata u svrhu razdvajanja i kvantitativne analize aminokiselina tečnom hromatografijom visokih performansi istraženo. Pošto nema intrinzičnu fluorescenciju, fankinon reaguje sa amino grupama aminokiselina (na 68 °C tokom 160 min), formirajući iminohinole, čija se fluorescencija meri na talasnoj dužini od 460 nm. Izolovani derivati su identifikovani Tm, IR, masenim i PMR spektrom. Tečna hromatografija visokih performansi je izvedena na hromatografu sa fluorescentnim detektorom i koloni sa gradijentom eluiranja sa smešama: rastvor trietilamina - fosfatni pufer (pH 3) - metanol. Kinidin je korišten kao interni standard. Ova metoda je prilično obećavajuća u velikim laboratorijama i može se predložiti za analizu aminokiselina u gotovim oblicima doze.
Razvijena je tehnika tečne hromatografije visokih performansi sa potenciometrijskim biosenzorom za kvantitativno određivanje lizina. Biosenzor je konstruisan pričvršćivanjem membrane koja sadrži lizin oksidazu na ionsko selektivnu NH4+ elektrodu. Joni amonijuma koji nastaju tokom enzimske razgradnje lizina detektuju se potenciometrijski. Razvijena je kromatodenzitometrijska ekspresna metoda za analizu triptofana u tekućinama kulture. Tankoslojna hromatografija je izvedena na Sorbfil pločama. Hromatografija je vršena u sistemu propanol-2 - 25% rastvor amonijum hidroksida (7:3) u trajanju od 25 minuta. Kromatogrami su osušeni na sobnoj temperaturi i držani na 120°C 15 min. Za detekciju mrlja na hromatogramima korišćen je specifični reagens - 4-dimetilaminobenzaldehid, selektivan za indolni prsten triptofana, u obliku 0,5% rastvora etanola uz dodatak 5% koncentrovane sumporne kiseline. Nakon razvijanja kromatograma uranjanjem u teflonsku kivetu sa svježe pripremljenim rastvorom 4-dimetilaminobenzaldehida, držani su 5-7 minuta na temperaturi od 110°C. Skeniranje triptofanskih mrlja obavljeno je na talasnoj dužini od 625 nm na kompjuterskom video denzitometru. Razvijena metoda, uprkos visoka tačnost definicije i performanse, specifične za triptofan.
Za analizu β-aminokiselina u biološkim tečnostima, lekovima i prehrambenim proizvodima, široko se koriste metode kapilarne elektroforeze zasnovane na razdvajanju komponenti. složena mešavina u kvarcnoj kapilari pod dejstvom apliciranog električno polje. Budući da su aminokiseline cviterionske prirode, mogu se odvojiti pomoću otopina elektrolita pufera odgovarajuće pH vrijednosti, najčešće se koriste neutralni i bazni puferi za razdvajanje.
Kako bi se povećala specifičnost i osjetljivost metode kapilarne elektroforeze za analizu pojedinačnih β-aminokiselina, koristi se njihova preliminarna derivatizacija, nakon čega slijedi odvajanje u kvarcnoj kapilari i spektrofotometrijsko određivanje produkta reakcije. Tako se 9-fluorenil metil format, 9-(2-karbazol)-etil hloroformat i cijaninska boja koriste kao derivatizatori. Izgledi metode su zbog prednosti kao što su brza analiza, lakoća pripreme uzorka, mala potrošnja reagensa i jednostavnost instrumentacije.
I proteini
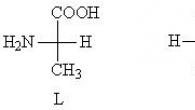
Poznato je da svih 20 varijanti kanonskih α-amino kiselina imaju istu strukturu, sa tri varijante funkcionalnih grupa (slika 3.3). Nažalost, reakcije na amino i karboksi grupe nisu baš specifične, jer shodno tome, karakteristični su za sve amine, brojne amide i karboksilne kiseline. Isto važi i za većinu njihovih radikala = R, od kojih je 10 nepolarnih, odnosno predstavljenih alifatskim = ugljovodoničnim grupama, od kojih je većina hemijski inertna. Specifičnost većine R polarnih aminokiselina, koje sadrže alkohol (Ser, Tre, Tyr), amidne (Asn, Gln) i karboksi grupe (Asp, Glu), takođe je relativno niska. Amino grupa (Lys), imidazol His i gvanidino grupa Arg su aktivnije, a aktivnost tio grupe Cys je maksimalna. Stoga najveći praktični značaj u kvalitativnoj i kvantitativnoj analizi α-aminokiselina, uključujući i analizatore aminokiselina, dobijena je univerzalna reakcija ninhidrina, specifična za istovremeno prisustvo i amino i karboksi grupa na α-C atomu.
Rice. 3.3. Opće formule strukture α-amino kiselina i njihovih proizvoda polimerizacije. Objašnjenja u tekstu.
Polimerizacija α-aminokiselina u strukturu peptida i proteina (slika 3.3) zadržava sve njihove R tipove, ali:
1. Reakcija ninhidrina postaje negativna, jer sa izuzetkom N- i C-terminalnih, α-amino i α-karboksi grupe troše se na formiranje peptidnih veza. Pozitivna reakcija ninhidrina s proteinom najvjerovatnije ukazuje na prisustvo nečistoća aminokiselina u preparatu ili posudi.
2. Za sve peptide i proteine, biuretska reakcija je specifična za peptidnu grupu koja je odsutna u monomernim amino kiselinama.
3. Od specifičnijih reakcija na R aminokiseline korisne su sljedeće: ksantoproteinska reakcija sa koncentrovanom dušičnom kiselinom, do aromatičnih R Fen, Tyr, Tri; reakcija sa izatinom na petočlanom Pro prstenu, kao i reakcije na imidazol R His, tio grupu Cys i gvanidino grupu Arg. Važno je uzeti u obzir da su neki od ovih R skriveni unutar proteinskih globula i stoga kvalitativne reakcije oslabio na njih. Stoga, prije nego što se provedu, proteini se obično denaturiraju na ovaj ili onaj način.
4. Za razliku od pravih rastvora aminokiselina, koloidni rastvori proteina se karakterišu sedimentne reakcije, povezano s uništavanjem njihovih hidratacijskih ljuski i, kao rezultat, smanjenjem njihove topljivosti pod utjecajem sredstava za uklanjanje vode: neutralne soli = isoljavanje, metanol = MeOH, etanol = EtOH, aceton, urea i drugi agensi.
Prilikom izvođenja kvalitativnih reakcija, trebali biste:
1. Pažljivo se pridržavajte pravila Sigurnost od požara i rad sa koncentriranim kiselinama i alkalijama = EZh.
2. Označite 2 reda epruveta staklenim grafikonom ili flomasterom i u jednu od njih stavite najviše 0,5 ml (2-5 kapi) 1% rastvora aminokiseline i približno istu zapreminu 1 % rastvora proteina u drugom.
3. U par epruveta sa rastvorima aminokiselina i proteina paralelno dodajte 3-5 kapi odgovarajućih reagensa i sprovedite preostale procedure navedene za odgovarajuću reakciju.
4. Ako je potrebno zagrijati epruvete, skinite poklopac lončića i zapalite suho gorivo šibicom. Zatim učvrstite epruvetu u držač, čiji je primitivni dizajn vrlo nepouzdan. Stoga je bolje zamotati nekoliko epruveta komadom papira presavijenim u trake i držeći ih thumb, prođe ravnomjerno donje polovine epruvete kroz plamen, izbjegavajući usmjeravanje vratova prema susjedima i izazivanje burnog ključanja otopine. Nakon završetka operacije, odmah ugasite plamen poklopcem lončića.
5. Rezultati eksperimenata se sastavljaju u skladu sa šablonom o širenju laboratorijske bilježnice u obliku tabele:

6. Razmotrivši dobijene rezultate i popunivši protokol, zajedno sa stalkom epruveta, predočiti ih nastavniku na zaštitu.
1. Ninhidrinska reakcija. Na osnovu deaminacije i dekarboksilacije α-amino kiselina sa alkoholnom otopinom ninhidrina:

Rezultirajući amonijak, reagirajući s dva molekula ninhidrina, formira obojeni derivat sa maksimumom apsorpcije na 540 nm (za Pro - 440 nm).
Napredak: Dodajte 3-5 kapi 0,5% u uzorke za ispitivanje alkoholni rastvor ninhidrin. Lagano zagrijte epruvete sa smjesama na plamenu i nakon 2-3 minute zabilježite izgled boje.
2. Ksantoproteinska reakcija. Kao što je gore pomenuto, zasniva se na formiranju nitro derivata aminokiselina sa aromatičnim R: Fen, Tyr, Tri.
Napredak: Uključujući propuh odvoda, pažljivo dodajte nekoliko kapi koncentrovane azotne kiseline (HNO 3) u par epruveta sa rastvorima za ispitivanje. Lagano zagrijte epruvete na plamenu, izbjegavajući usmjeravanje vrata prema susjedima, i zabilježite razvoj boje.
3. Nitroprusidna reakcija. Zasnovan je na alkalnoj hidrolizi cisteina aminokiseline koja sadrži sumpor, uz oslobađanje natrijum sulfida (Na 2 S), koji daje crveni kompleks sa svježe pripremljenom otopinom natrijum nitroprusida.

napredak: Dodajte 5-10 kapi rastvora za ispitivanje u obe epruvete jednaku zapreminu 20 % kausticna soda i kuvajte najmanje 3-5 minuta. Dodajte 3-5 kapi rastvora natrijum nitroprusida u epruvete i zabeležite razvoj boje.
4. Biuret reakcija. Zasniva se na formiranju obojenog kompleksa peptidne veze sa Cu 2+ jonom u alkalnoj sredini. Služi kao univerzalni test za identifikaciju peptida i proteina u rastvorima. Budući da sa povećanjem broja peptidnih veza, intenzitet boje otopine raste linearno, široko se koristi za fotometrijsko određivanje koncentracije proteina.
Napredak. Dodajte istu količinu 10% rastvora natrijum hidroksida u epruvete sa 5-10 kapi rastvora za ispitivanje. Dobro promešajte i dodajte 2 kapi 1% rastvora bakar sulfata (CuSO 4). Pomiješajte uzorke i zabilježite razvoj boje nakon nekoliko minuta.
5. Test ključanja. Zasnovano na termalnoj denaturaciji proteina.
Napredak. Zakiseli obje epruvete ispitnim otopinama s najviše jednom kapi 1% otopine octene kiseline (AcOH) i zagrijte do ključanja. Nakon kuhanja otopina 2-3 minute, zabilježite rezultate i objasnite mehanizam pojave.
6. Taloženje solima teških metala(meh) . Njihova denaturirajuća svojstva zasnivaju se na sposobnosti teških Me kationa da reaguju sa R funkcionalnim grupama proteinskog molekula: tio-, amino-, karboksi-, aromatičnim. Također, njihovi jaki anjoni uzrokuju ponovno punjenje jonskih grupa u proteinskim molekulima, čime se uništavaju jonske veze u njima.
Napredak. Dodajte nekoliko kapi 5% rastvora bakar sulfata (CuSO 4) u obe epruvete sa rastvorima za ispitivanje. Zabilježite i objasnite dobivene rezultate.
7. Taloženje organskim kiselinama. Zasnovano na kiseloj denaturaciji proteina i formiranju kovalentnih derivata tio-, amino- i aromatičnih grupa R aminokiselina sa organohlorima.
Napredak. Dodajte nekoliko kapi 10% rastvora trihloroctene kiseline (TCA) u epruvete sa rastvorima za ispitivanje i nakon nekoliko minuta zabeležite rezultate
Oprema i reagens: papir za kromatografiju; komora za hromatografiju; fotoelektrični kolorimetar; škare; staklene ploče (3´32 cm) - 3 kom.; Držač za kromatograme; Ormar za sušenje; mikropipete; epruvete sa brušenim čepovima; bireta 25 ml; standardna mješavina aminokiselina; test mješavina aminokiselina; butanol, sirćetna kiselina, voda u omjeru 15:3:7; 1% rastvor ninhidrina u 95% acetonu; etil alkohol (75%), zasićen bakar sulfatom.
Završetak radova
Uzmite list hromatografskog papira dimenzija 18 x 28 cm i jednostavnom olovkom nacrtajte horizontalnu liniju na udaljenosti od 3 cm od njegove kratke ivice. Zatim se dijeli na nejednake segmente u skladu sa priloženim dijagramom i strelicama se označavaju granice primjene standardne i ispitne mješavine, a jednostavnim olovkom se prave odgovarajući natpisi.
Papir se ojačava iznad površine stola i standardna smjesa se prvo nanosi na startnu liniju, ograničenu strelicama, posebnom mikropipetom u tankoj liniji dok se cijeli rastvor iz mikropipete ne prenese na startnu liniju (mikropipeta se ispunjen do 2-3 cm). Masa apliciranog rastvora se meri vaganjem pipete napunjene standardnom smešom (pre nanošenja rastvora) i prazne (nakon primene rastvora). Na papir se obično nanosi 0,02-0,03 g standardnog rastvora. Zatim napunite čistu pipetu ispitnom mješavinom aminokiselina (koju je izdao nastavnik za studiju), izmjerite je i nanesite smjesu na startnu liniju s odgovarajućom oznakom.
Pripremljeni hromatogram se stavlja u hromatografsku komoru u koju je prethodno uliven sistem rastvarača da se odvoji mešavina aminokiselina, na primer, mešavina butanola, sirćetne kiseline i vode u odnosu 15:3:7. Odvajanje se vrši uzlaznom hromatografijom sve dok prednja linija ne dostigne 2-3 cm do gornje ivice hromatografskog papira (finišne linije). Nakon toga, hromatogram se vadi iz komore i gornji kraj papira se odmah ubacuje u držač sastavljen od tri staklene šipke pričvršćene gumenim prstenom i stavljaju u dimovod na 20 minuta kako bi se uklonili rastvarači iz papira.
Rice. 8. Šema rasporeda aminokiselina na hromatogramu:
A - tačka primene mešavine aminokiselina; I - cistin i cistein;
2 - lizin; 3 - histidin; 4 - arginin; 5 - asparaginska kiselina,
serija i glicin; 6 - glutaminska kiselina i treonin; 7 - alanin;
8 - prolin; 9 - tirozin; 10 - valin i metionin; II - triptofan;
12 - fenilalanin; 13 – leucin i izoleucin
Osušeni kromatogram se umoči u 1% otopinu ninhidrina u acetonu da bi se otkrio položaj aminokiselinskih mrlja na njemu. Zatim se hromatogram stavlja u dimovod na 10 minuta kako bi se uklonio aceton i prenosi u sušač, gdje se ostavlja 15 minuta na 70°C. Aminokiseline standardne i test mješavine detektiraju se u obliku plavo-ljubičastih mrlja smještenih u lancu u smjeru kretanja sistema rastvarača od početne linije do gornje ivice hromatograma.
Identifikacija aminokiselina sadržanih u ispitivanoj mješavini vrši se podudarnošću u hromatogramu pozicija koje zauzimaju aminokiseline standardne i test mješavine (slika 8).
Da bi se odredio kvantitativni sadržaj aminokiselina u ispitivanim smjesama, kromatogram se crta jednostavnom olovkom tako da se obojene zone koje leže na istom nivou, a koje odgovaraju istoj aminokiselini, nalaze unutar približno identičnih pravokutnika (slika 9) .
I II III IV

Rice. 9. Raspored aminokiselina na hromatogramu:
I - smeša br. I; II - smeša br. 2; 1U - mješavina br. 3; Š - standardno
mješavina aminokiselina
Ocrtane površine papira se izrezuju i stavljaju u epruvete, čiji brojevi moraju odgovarati broju tačaka na hromatogramima. U svaku epruvetu iz birete se sipa 10 ml 75% rastvora. etil alkohol zasićen mednim sulfatom (dodati 0,2 ml zasićenog rastvora bakar sulfata u 500 ml etil alkohola). Epruveta se zatvori i, povremeno miješajući, cigla-crvena boja (Ruheman plavo-ljubičasta bakrena sol) se potpuno prenosi sa papira u otopinu. Ovo traje 15-20 minuta. Apsorpcija (optička gustina) standardnih i ispitnih rastvora se meri na fotoelektričnom kalorimetru sa filterom zelene svetlosti (540 nm). U referentni tok ugrađuje se kiveta sa 75% rastvorom etil alkohola sa bakar sulfatom.
Kvantitativni sadržaj aminokiselina u ispitivanoj otopini izračunava se iz omjera ekstinkcija testnog i standardnog uzorka.
Primjer izračuna. Pretpostavimo da standardna smjesa sadrži 1,8 mg glicina u 1 ml, a 0,02 g ove standardne otopine nanese se na početnu traku. Dakle, hromatogram je dobio (1,8 × 0,02) = 0,036 mg glicina. Dalje se složimo da je apsorpcija obojenih rastvora bila 0,288 za standardnu i 0,336 za nepoznatu smešu. Tada će sadržaj glicina u ispitivanoj smjesi, ucrtan na hromatogramu, biti (36´0,336): 0,288=42 μg. Ako dalje pretpostavimo da se ispitna smjesa nanese na hromatogram u količini od, na primjer, 0,0250 g, tada će sadržaj glicina u 1 ml ispitne otopine biti (42:0,0250) = 1680 μg, odnosno 1,68 mg/ ml.
Predstavite rezultate vlastitog eksperimenta i izvucite zaključke iz njih.
Laboratorijski rad br.15
Odvajanje jonaFe 3+ , Co 2+ , Ni 2+
Aminokiseline se mogu detektovati pomoću reakcija u boji: ninhidrin, ksantoprotein, Foly, Milone, biuret test, itd. Ove reakcije su nespecifične, jer zasnivaju se na detekciji pojedinačnih fragmenata u strukturi aminokiselina, koji se mogu naći i u drugim spojevima.
Ninhidrinska reakcija, reakcija u boji koja se koristi za kvalitativno i kvantitativno određivanje aminokiselina, iminokiselina i amina. Kada se zagreje u alkalnoj sredini, ninhidrin (tricetohidrin dehidrat, C 9 H b O 4) sa supstancama koje imaju primarne amino grupe (-NH 2), nastaje proizvod koji ima stabilnu intenzivnu plavo-ljubičastu boju sa maksimalnom apsorpcijom od oko 570 nm. Pošto apsorpcija na ovoj talasnoj dužini linearno zavisi od broja slobodnih amino grupa, reakcija ninhidrina je poslužila kao osnova za njihovo kvantitativno određivanje kolorimetrijom ili spektrofotometrijom. Ova reakcija se takođe koristi za određivanje sekundarnih amino grupa (>NH) u iminokiselinama - prolinu i hidroksiprolinu; u ovom slučaju nastaje svijetlo žuti proizvod. Osetljivost - do 0,01%. Moderna automatska analiza aminokiselina provodi se kombinacijom razdvajanja aminokiselina ionskom izmjenom i njihovog kvantitativnog određivanja reakcijom ninhidrina. Prilikom odvajanja mješavine aminokiselina pomoću papirne hromatografije, omogućava se određivanje svake aminokiseline u količini od najmanje 2-5 μg.
Intenzitet boje može se koristiti za procjenu količine aminokiselina.
Ova reakcija je pozitivna ne samo na slobodne aminokiseline, već i na peptide, proteine itd.
Ksantoproteinska reakcija omogućava vam da otkrijete aromatične aminokiseline(fenilalanin, tirozin, histidin, triptofan), na osnovu reakcije elektrofilne supstitucije u aromatičnom prstenu (nitracija).

Kada koncentrirana dušična kiselina djeluje, na primjer, na tirozin, nastaje žuto obojeni produkt.
Foll reakcija. Ovo je reakcija na cistein i cistin. Tijekom alkalne hidrolize, "slabo vezan sumpor" u cisteinu i cistinu se prilično lako odvaja, što rezultira stvaranjem sumporovodika, koji, reagirajući s alkalijom, proizvodi natrij ili kalij sulfide. Kada se doda olovo(II) acetat, formira se sivo-crni talog olovo(II) sulfida.
Opis iskustva. U epruvetu se sipa 1 ml rastvora cistina, doda se 0,5 ml 20% rastvora natrijum hidroksida. Smjesa se zagrije do ključanja, a zatim se doda 0,5 ml otopine olovo(II) acetata. Uočen je sivo-crni talog olovo(II) sulfida:

Zimmermanova reakcija. Ovo je reakcija na aminokiselinu glicin.
Opis iskustva. U 2 ml 0,1% rastvora glicina, podešenog dodavanjem 10% rastvora alkalije na pH = 8, dodajte 0,5 ml vodenog rastvora o-ftalnog dialdehida. Reakciona smeša polako počinje da postaje svetlo zelena. Nakon nekoliko minuta pojavljuje se zeleni talog.
Reakcija na triptofan. Reakcija triptofana kisela sredina sa aldehidima, stvara obojene kondenzacijske produkte. Na primjer, s glioksilnom kiselinom (koja je dodatak koncentrovanoj kiselini sirćetna kiselina) reakcija se odvija prema jednadžbi:

Reakcija triptofana s formaldehidom odvija se prema sličnoj shemi.
Sakaguchijeva reakcija. Ova reakcija na aminokiselinu arginin se zasniva na interakciji arginina sa α-naftolom u prisustvu oksidacionog agensa. Njegov mehanizam još nije u potpunosti razjašnjen. Očigledno, reakcija se odvija prema sljedećoj jednadžbi:

Budući da derivati kinoneimina (in u ovom slučaju naftohinon), u kojima je vodonik imino grupe –NH– zamijenjen alkilnim ili arilnim radikalom, uvijek su obojeni žuto-crveno, tada, po svemu sudeći, narandžasto-crvene boje rješenje tokom Sakaguchi reakcije objašnjava se pojavom derivata naftohinon imina. Međutim, ne može se isključiti mogućnost stvaranja još složenijeg spoja uslijed dalje oksidacije preostalih NH grupa argininskog ostatka i benzenskog prstena α-naftola:

Opis iskustva. U epruvetu se sipa 2 ml 0,01% rastvora arginina, zatim se doda 2 ml 10% rastvora natrijum hidroksida i nekoliko kapi 0,2% rastvora alkohola α-naftola. Sadržaj epruvete se dobro promeša, doda se 0,5 ml rastvora hipobromita i ponovo promeša. Odmah dodati 1 ml 40% rastvora uree da stabilizuje narandžasto-crvenu boju koja se brzo razvija.
Biuret reakcija– koristi se kao reakcija boje na proteine. U alkalnoj sredini u prisustvu soli bakra(II) daju ljubičastu boju. Boja je posljedica formiranja kompleksnog spoja bakra(II) zbog peptidne grupe -CO-NH-, što je karakteristično za proteine. Ova reakcija je dobila ime po derivatu uree - biuretu, koji nastaje kada se urea zagrije uz eliminaciju amonijaka:
Pored proteina i biureta, istu boju daju i druga jedinjenja koja sadrže ovu grupu: amidi, imidi karboksilnih kiselina, kao i jedinjenja koja sadrže grupe -CS-NH- ili =CH-NH- u molekulu. Reaguju i proteini, neke aminokiseline, peptidi, biuret i srednji peptoni.
Boja kompleksa dobijenog reakcijom biureta sa različitim peptidima je nešto drugačija i zavisi od dužine peptidnog lanca. Peptidi sa dužinom lanca od četiri aminokiselinska ostatka i iznad formiraju crveni kompleks, tripeptidi - ljubičasti, a dipeptidi - plavi.

ketonski oblik polipeptida

enolni oblik polipeptida
Kada polipeptid stupi u interakciju sa Cu (OH) 2, formira se kompleks čija se struktura može prikazati na sljedeći način.