V lekcii 13 "" z kurzu " Chémia pre figuríny» zvážiť, prečo sú potrebné chemické rovnice; Naučme sa, ako vyrovnať chemické reakcie správnym usporiadaním koeficientov. Táto lekcia bude vyžadovať, aby ste poznali základnú chémiu z predchádzajúcich lekcií. Nezabudnite si prečítať o elementárnej analýze, kde nájdete hĺbkový pohľad na empirické vzorce a chemickú analýzu.
V dôsledku spaľovacej reakcie metánu CH4 v kyslíku O2 vzniká oxid uhličitý CO2 a voda H20 chemická rovnica:
- CH 4 + O 2 → CO 2 + H20 (1)
Skúsme z chemickej rovnice vydolovať viac informácií ako len indikáciu produkty a činidlá reakcie. Chemická rovnica (1) nie je úplná, a preto neposkytuje žiadnu informáciu o tom, koľko molekúl O 2 sa spotrebuje na 1 molekulu CH 4 a koľko molekúl CO 2 a H20 sa získa ako výsledok. Ak však pred príslušné molekulové vzorce zapíšeme číselné koeficienty, ktoré udávajú, koľko molekúl každého typu sa zúčastňuje reakcie, dostaneme úplná chemická rovnica reakcie.
Aby ste dokončili zloženie chemickej rovnice (1), musíte si zapamätať jedno jednoduché pravidlo: ľavá a pravá strana rovnice musí obsahovať rovnaký počet atómov každého typu, pretože počas chemickej reakcie nevznikajú žiadne nové atómy. vytvorené a existujúce nie sú zničené. Toto pravidlo vychádza zo zákona zachovania hmotnosti, o ktorom sme hovorili na začiatku kapitoly.
Je to potrebné na získanie úplnej rovnice z jednoduchej chemickej rovnice. Prejdime teda k skutočnej rovnici reakcie (1): pozrime sa ešte raz na chemickú rovnicu, presne na atómy a molekuly na pravej a ľavej strane. Je ľahké vidieť, že reakcia zahŕňa tri typy atómov: uhlík C, vodík H a kyslík O. Spočítajme a porovnajme počet atómov každého typu na pravej a ľavej strane chemickej rovnice.

Začnime uhlíkom. Na ľavej strane je jeden atóm uhlíka súčasťou molekuly CH4 a na pravej strane je jeden atóm uhlíka súčasťou CO2. Na ľavej a pravej strane je teda počet atómov uhlíka rovnaký, takže to necháme tak. Ale pre prehľadnosť dajme pred molekuly s uhlíkom koeficient 1, aj keď to nie je potrebné:
- 1CH4 + O2 → 1CO2 + H20 (2)
Potom prejdeme k počítaniu atómov vodíka H. Na ľavej strane sú v molekule CH 4 4 atómy H (v kvantitatívnom zmysle H 4 = 4H) a na pravej strane sú v molekule CH 4 len 2 atómy H. molekula H 2 O, čo je dvakrát menej ako na ľavej strane chemickej rovnice (2). Poďme vyrovnať! Aby sme to dosiahli, dajme pred molekulu H2O koeficient 2. Teraz budeme mať 4 molekuly vodíka H v reaktantoch aj produktoch:
- 1CH4+02 → 1CO2 + 2H20 (3)
Upozorňujeme, že koeficient 2, ktorý sme napísali pred molekulu vody H 2 O, aby sme vyrovnali vodík H, sa 2-násobne zväčšia všetky atómy zahrnuté v jej zložení, t.j. 2H 2 O znamená 4H a 2O. Dobre, zdá sa, že sme to vyriešili, zostáva len spočítať a porovnať počet atómov kyslíka O v chemickej rovnici (3). Hneď vás upúta, že na ľavej strane je presne 2-krát menej atómov O ako na pravej. Teraz už viete, ako vyvážiť chemické rovnice sami, takže okamžite zapíšem konečný výsledok:
- 1CH4 + 202 → 1CO2 + 2H20 alebo CH4 + 202 → CO2 + 2H20 (4)
Ako vidíte, vyrovnávanie chemických reakcií nie je až taká zložitá vec a nie je tu dôležitá chémia, ale matematika. Rovnica (4) sa nazýva úplná rovnica chemická reakcia, pretože sa riadi zákonom zachovania hmoty, t.j. počet atómov každého typu, ktoré vstupujú do reakcie, sa presne zhoduje s počtom atómov tohto typu po dokončení reakcie. Každá strana tejto úplnej chemickej rovnice obsahuje 1 atóm uhlíka, 4 atómy vodíka a 4 atómy kyslíka. Je však potrebné pochopiť niekoľko dôležitých bodov: chemická reakcia je zložitá sekvencia jednotlivých medzistupňov, a preto napríklad rovnicu (4) nemožno interpretovať v tom zmysle, že 1 molekula metánu sa musí súčasne zraziť s 2 kyslíkmi. molekuly. Procesy, ktoré sa vyskytujú počas tvorby reakčných produktov, sú oveľa zložitejšie. Druhý bod: úplná rovnica reakcie nám nehovorí nič o jej molekulárnom mechanizme, teda o postupnosti dejov, ktoré sa vyskytujú na molekulárnej úrovni počas jej priebehu.
Koeficienty v rovniciach chemických reakcií
Ďalší jasný príklad, ako sa správne zariadiť kurzov v rovniciach chemickej reakcie: Trinitrotoluén (TNT) C 7 H 5 N 3 O 6 sa prudko spája s kyslíkom za vzniku H 2 O, CO 2 a N 2. Zapíšme si reakčnú rovnicu, ktorú vyrovnáme:
- C7H5N3O6 + O2 → CO2 + H20 + N2 (5)
Je jednoduchšie zostaviť úplnú rovnicu založenú na dvoch molekulách TNT, pretože ľavá strana obsahuje nepárny počet atómov vodíka a dusíka a pravá strana obsahuje párne číslo:
- 2C7H5N3O6 + O2 → CO2 + H20 + N2 (6)
Potom je jasné, že 14 atómov uhlíka, 10 atómov vodíka a 6 atómov dusíka sa musí zmeniť na 14 molekúl oxidu uhličitého, 5 molekúl vody a 3 molekuly dusíka:
- 2C7H5N3O6 + O2 → 14CO2 + 5H20 + 3N2 (7)
Teraz obe časti obsahujú rovnaký počet všetkých atómov okrem kyslíka. Z 33 atómov kyslíka prítomných na pravej strane rovnice je 12 dodaných dvoma pôvodnými molekulami TNT a zvyšných 21 musí byť dodaných 10,5 molekulami O2. Úplná chemická rovnica teda bude vyzerať takto:
- 2C7H5N3O6 + 10,502 → 14C02 + 5H20 + 3N2 (8)
Môžete vynásobiť obe strany 2 a zbaviť sa neceločíselného koeficientu 10,5:
- 4C7H5N3O6 + 2102 → 28CO2 + 10H20 + 6N2 (9)
To však nie je potrebné, pretože všetky koeficienty rovnice nemusia byť celé čísla. Ešte správnejšie by bolo vytvoriť rovnicu založenú na jednej molekule TNT:
- C7H5N3O6 + 5,2502 -> 7C02 + 2,5H20 + 1,5N2 (10)
Kompletná chemická rovnica (9) obsahuje množstvo informácií. V prvom rade označuje východiskové látky - činidlá, a Produkty reakcie. Okrem toho ukazuje, že počas reakcie sú všetky atómy každého typu jednotlivo zachované. Ak obe strany rovnice (9) vynásobíme Avogadrovým číslom N A = 6,022 10 23, môžeme konštatovať, že 4 móly TNT zreagujú s 21 mólmi O 2 za vzniku 28 mólov CO 2, 10 mólov H 2 O a 6 mol N2.
Je tu ešte jeden trik. Pomocou periodickej tabuľky určujeme molekulové hmotnosti všetkých týchto látok:
- C7H5N3O6 = 227,13 g/mol
- 02 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H20 = 18,015 g/mol
- N2 = 28,013 g/mol
Teraz rovnica 9 bude tiež indikovať, že 4 227,13 g = 908,52 g TNT vyžaduje 21 31,999 g = 671,98 g kyslíka na dokončenie reakcie a ako výsledok sa vytvorí 28 44,010 g = 1232,3 g CO2, 10 · 18,01 = 10 · 18,01 g H20 a 6-28,013 g = 168,08 g N2. Pozrime sa, či je v tejto reakcii splnený zákon zachovania hmotnosti:
| Činidlá | Produkty | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H20 | |
| 168,08 g N2 | ||
| Celkom | 1580,5 g | 1580,5 g |
Jednotlivé molekuly sa však nemusia nevyhnutne zúčastniť chemickej reakcie. Napríklad reakcia vápenca CaCO3 a kyseliny chlorovodíkovej HCl za vzniku vodného roztoku chloridu vápenatého CaCl2 a oxidu uhličitého CO2:
- CaC03 + 2HCl → CaCl2 + CO2 + H20 (11)
Chemická rovnica (11) opisuje reakciu uhličitanu vápenatého CaC03 (vápenec) a kyseliny chlorovodíkovej HCl za vzniku vodného roztoku chloridu vápenatého CaCl2 a oxidu uhličitého CO2. Táto rovnica je úplná, pretože počet atómov každého typu na ľavej a pravej strane je rovnaký.
Význam tejto rovnice je makroskopická (molárna) úroveň je nasledovný: 1 mól alebo 100,09 g CaC03 vyžaduje 2 móly alebo 72,92 g HCl na dokončenie reakcie, výsledkom čoho je 1 mól CaCl2 (110,99 g/mol), C02 (44,01 g/mol) a H2 O (18,02 g/mol). Z týchto číselných údajov je ľahké overiť, či je pri tejto reakcii splnený zákon zachovania hmotnosti.
Interpretácia rovnice (11) na mikroskopickej (molekulárnej) úrovni nie je tak zrejmé, keďže uhličitan vápenatý je soľ, nie molekulárna zlúčenina, a preto chemickú rovnicu (11) nemožno chápať v tom zmysle, že 1 molekula uhličitanu vápenatého CaCO 3 reaguje s 2 molekulami HCl. Okrem toho molekula HCl v roztoku vo všeobecnosti disociuje (rozpadá sa) na ióny H+ a Cl-. Správnejší popis toho, čo sa deje v tejto reakcii na molekulárnej úrovni, je teda daný rovnicou:
- CaC03 (sol.) + 2H+ (aq.) → Ca2+ (aq.) + C02 (g.) + H20 (1.) (12)
Tu je fyzikálny stav každého typu častíc stručne uvedený v zátvorkách ( TV- ťažké, aq.- hydratovaný ión vo vodnom roztoku, G.- plyn, a.- kvapalina).
Rovnica (12) ukazuje, že pevný CaCO 3 reaguje s dvoma hydratovanými iónmi H +, pričom vytvára kladný ión Ca 2+, CO 2 a H 2 O. Rovnica (12), podobne ako iné úplné chemické rovnice, nedáva predstavu o reakcie molekulárneho mechanizmu a je menej vhodný na počítanie množstva látok, poskytuje však lepší popis toho, čo sa deje na mikroskopickej úrovni.
Upevnite si svoje znalosti o zostavovaní chemických rovníc tým, že si sami prejdete príklad s riešením:
Dúfam, že z lekcie 13" Písanie chemických rovníc„Naučil si sa niečo nové pre seba. Ak máte nejaké otázky, napíšte ich do komentárov.
Algoritmus
Usporiadanie koeficientov v rovniciach chemických reakcií
Učiteľ chémie MBOU stredná škola č.2
Volodčenko Svetlana Nikolajevna
Ussurijsk
USPORIADANIE KOEFICIENTOV V ROVNICI CHEMICKÝCH REAKCIÍ
Počet atómov jedného prvku na ľavej strane rovnice sa musí rovnať počtu atómov tohto prvku na pravej strane rovnice.
Úloha 1 (pre skupiny).Určte počet atómov každého chemického prvku, ktorý sa zúčastňuje reakcie.
1. Vypočítajte počet atómov:
A) vodík: 8NH3, NaOH, 6NaOH, 2NaOH,NZRO4, 2H2S04, 3H2S04, 8H2S04;
6) kyslík: C02, 3C02, 2C02, 6CO, H2S04, 5H2S04, 4H2S04, HN03.
2. Vypočítajte počet atómov: a)vodík:
1) NaOH + HCl 2) CH4+H20 3)2Na+H2
b) kyslík:
1) 2СО + 02 2) С02 + 2Н.О. 3)4N02 + 2H20 + O2
Algoritmus na usporiadanie koeficientov v rovniciach chemických reakcií
А1 + О2→ А12О3Atóm A1-1 A1-2
O-2 atóm O-3
2. Spomedzi prvkov s rôznym počtom atómov v ľavej a pravej časti diagramu vyberte ten, ktorého počet atómov je väčší
Atómy O-2 vľavo
O-3 atómy vpravo
3. Nájdite najmenší spoločný násobok (LCM) počtu atómov tohto prvku na ľavej strane rovnice a počtu atómov tohto prvku na pravej strane rovnice
LCM = 6
4. Vydeľte LCM počtom atómov tohto prvku na ľavej strane rovnice, získajte koeficient pre ľavú stranu rovnice
6:2 = 3
Al + ZO 2 →Al 2 O 3
5. Vydeľte LCM počtom atómov tohto prvku na pravej strane rovnice, získajte koeficient pre pravú stranu rovnice
6:3 = 2
A1+ O 2 →2A1 2 O3
6. Ak nastavený koeficient zmenil počet atómov iného prvku, potom zopakujte kroky 3, 4, 5 znova.
A1 + ZO 2 → →2A1 2 O 3
A1-1 atóm A1-4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → →2A1 2 O 3
. Primárny test získavania vedomostí (8-10 min .).
Na ľavej strane diagramu sú dva atómy kyslíka a jeden na pravej. Počet atómov sa musí vyrovnať pomocou koeficientov.
1) 2Mg+02 →2MgO
2) CaCO3 + 2HCl->CaCl2 + N2 O + CO2
Úloha 2 Umiestnite koeficienty do rovníc chemických reakcií (všimnite si, že koeficient mení počet atómov iba jedného prvku):
1. Fe 2 O 3 + A l → A l 2 O 3 + Fe; Mg+N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1+ S → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr+Al 2 O 3 ; Ca+P → Ca 3 P 2 ;
4. C + H 2 → CH 4 ; Ca + C → SaS 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na+S → Na 2 S; CaO+ S → CaC 2 + CO;
7.Ca+N 2 → C a 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; N 2 + S l 2 → NS l;
9.N 2 + O 2 → NIE; CO 2 + S → CO ;
10. HI → N 2 → + 1 2 ; Mg+ NS l → MgCl 2 + N 2 ;
11.FeS+ NS 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;
12. Br 2 + KI → KBr+I 2 ; Si+HF (r) → SiF 4 +H 2 ;
1./HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + S → Si + CO;
15. SiO 2 + S → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Aká je rovnica chemickej reakcie?
2.Čo je napísané na pravej strane rovnice? A vľavo?
3.Čo znamená znamienko „+“ v rovnici?
4. Prečo sú koeficienty umiestnené v chemických rovniciach?
Existuje niekoľko metód na určenie koeficientov v rovniciach redoxných reakcií. Používame metódu elektronickej váhy, pri ktorej sa zostavenie kompletnej rovnice OVR vykonáva v nasledujúcom poradí:
1. Zostavte reakčný diagram s uvedením látok, ktoré reagovali, a látok, ktoré sú výsledkom reakcie, napríklad:
2. Určte oxidačný stav atómov a nad symboly prvkov napíšte jeho znamienko a hodnotu, pričom si poznačte prvky, ktorých oxidačný stav sa zmenil:
3. Napíšte elektrónové rovnice pre oxidačné a redukčné reakcie, určite počet elektrónov odovzdaných redukčným činidlom a prijatých oxidačným činidlom a potom ich vyrovnajte vynásobením príslušnými koeficientmi:
4. Získané koeficienty zodpovedajúce elektronickej váhe sa prenesú do hlavnej rovnice:
5. Vyrovnajte počet atómov a iónov, ktoré nemenia oxidačný stav (v poradí: kovy, nekovy, vodík):
6. Skontrolujte správnosť výberu koeficientov na základe počtu atómov kyslíka na ľavej a pravej strane reakčnej rovnice - mali by sa rovnať (v tejto rovnici 24 = 18 + 2 + 4, 24 = 24).
Pozrime sa na zložitejší príklad:
Stanovme oxidačné stavy atómov v molekulách:
Vytvorme elektronické rovnice pre oxidačné a redukčné reakcie a vyrovnáme počet daných a prijatých elektrónov:
Prenesme koeficienty do hlavnej rovnice:
Vyrovnajme počet atómov, ktoré nemenia oxidačný stav:
Spočítaním počtu atómov kyslíka na pravej a ľavej strane rovnice sa presvedčíme o správnom výbere koeficientov.
Najdôležitejšie oxidačné a redukčné činidlá
Redoxné vlastnosti prvkov závisia od štruktúry elektronického obalu atómov a sú určené ich polohou v periodickej tabuľke Mendelejeva.
Kovy, ktoré majú 1-3 elektróny na vonkajšej energetickej úrovni, sa ich ľahko vzdávajú a vykazujú iba redukčné vlastnosti. Nekovy (prvky skupín IV-VII) môžu darovať aj prijímať elektróny, takže môžu vykazovať redukčné aj oxidačné vlastnosti. V obdobiach s nárastom atómového čísla prvku sa oslabujú redukčné vlastnosti jednoduchých látok a zvyšujú sa oxidačné vlastnosti. V skupinách s nárastom poradového čísla sa zvyšujú redukčné vlastnosti a oslabujú sa oxidačné vlastnosti. teda z jednoduchých látok sú najlepšie redukčné činidlá alkalické kovy, hliník, vodík, uhlík; najlepšie oxidačné činidlá sú halogény a kyslík.
Redoxné vlastnosti komplexných látok závisia od stupňa oxidácie atómov, ktoré ich tvoria. Látky obsahujúce atómy s najnižším oxidačným stavom vykazujú redukčné vlastnosti. Najdôležitejšie redukčné činidlá sú oxid uhoľnatý  , sírovodík
, sírovodík  síran železnatý
síran železnatý  .Látky obsahujúce atómy s najvyšším oxidačným stavom vykazujú oxidačné vlastnosti. Najdôležitejšie oxidačné činidlá sú manganistan draselný
.Látky obsahujúce atómy s najvyšším oxidačným stavom vykazujú oxidačné vlastnosti. Najdôležitejšie oxidačné činidlá sú manganistan draselný  dvojchróman draselný
dvojchróman draselný  , peroxid vodíka
, peroxid vodíka  , Kyselina dusičná
, Kyselina dusičná  , koncentrovaná kyselina sírová
, koncentrovaná kyselina sírová  .
.
Látky obsahujúce atómy so strednými oxidačnými stavmi sa môžu správať ako oxidačné alebo redukčné činidlá v závislosti od vlastností látok, s ktorými interagujú, a od reakčných podmienok. Takže v reakcii s  kyselina sírová má redukčné vlastnosti:
kyselina sírová má redukčné vlastnosti:
a pri interakcii so sírovodíkom ide o oxidačné činidlo:

Okrem toho sú pre takéto látky možné samooxidačno-samo-redukčné reakcie, ktoré sa vyskytujú pri súčasnom zvýšení a znížení oxidačného stavu atómov toho istého prvku, napríklad:
Sila mnohých oxidačných a redukčných činidiel závisí od pH média. Napríklad, 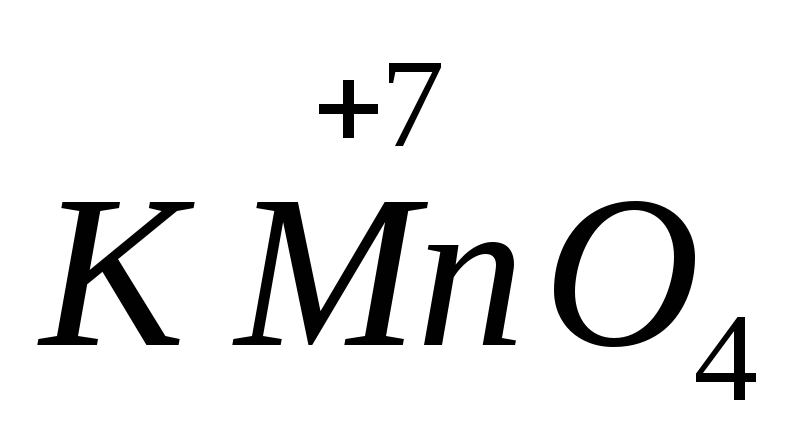 v alkalickom prostredí sa redukuje na
v alkalickom prostredí sa redukuje na  , v neutrálnom až
, v neutrálnom až  , v prítomnosti kyseliny sírovej - až
, v prítomnosti kyseliny sírovej - až  .
.
L  Je ľahké umiestniť koeficienty do chemických rovníc?
Je ľahké umiestniť koeficienty do chemických rovníc?
Moje deti teda vyrástli na chémiu (som triedna učiteľka v 8. “B” ročníku). Chémia sa najčastejšie učia deti na prvej hodine, ale vo štvrtok som nemala prvú hodinu a požiadala som, aby som išla na hodinu Valentiny Ivanovnej „pozrieť sa na deti“ a skontrolovať denníky. Táto téma ma zaujala v škole som miloval chémiu a nekontroloval som si denníky. Opäť som sa presvedčila, že študenti najčastejšie pociťujú ťažkosti z toho dôvodu, že nevidia medzipredmetové súvislosti. V tejto hodine chémie sa od študentov vyžadovalo, aby vytvorili chemické rovnice tak, že poznali mocnosť chemikálií. A mnohí študenti mali problém určiť číselné koeficienty. V sobotu sme mali s Valentinou Ivanovnou ďalšiu hodinu chémie.
Cvičenie 1.
Napíšte nasledujúce vety ako chemické rovnice:
A) „Pri pražení uhličitanu vápenatého vzniká oxid vápenatý a oxid uhoľnatý (IV)“; b) „Keď oxid fosforečný (V) reaguje s vodou, vzniká kyselina fosforečná.
Riešenie:
A) CaCO 3 = CaO + CO 2 - reakcia je endotermická. S touto úlohou neboli žiadne ťažkosti, pretože nebolo potrebné hľadať číselné koeficienty. Na začiatku obsahuje ľavá a pravá strana rovnice jeden atóm vápnika, jeden atóm uhlíka a tri atómy kyslíka.
B) P205 + 3H20 = 2H3P04 - reakcia je exotermická. S druhou rovnicou bez číselných koeficientov boli problémy, nevyšla správna rovnosť: P 2 O 5 + H 2 O → H 3 PO 4 . Je zrejmé, že na vytvorenie správnej rovnosti musíte vybrať číselné koeficienty. Ak vyberiete, môžete začať s fosforom: dva atómy sú vľavo a jeden vpravo, takže pred vzorec kyseliny dusičnej vložíme číselný faktor rovný dvom a potom dostaneme: P 2 O 5 + H 20 -> 2H3P04. Teraz však zostáva vyrovnať počet atómov kyslíka a vodíka: vľavo sú dva atómy vodíka a vpravo šesť atómov, takže pred vzorec vody dáme číselný koeficient rovný trom a potom dostaneme: P 205 + 3H20 -> 2H3P04. Teraz je ľahké overiť, že v každej časti rovnice sú rovnaké množstvá atómov fosforu, atómov vodíka a atómov kyslíka, preto sme dostali správnu rovnicu chemickej reakcie: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
Druhý spôsob: algebraické. Predpokladajme, že do rovnice vložíme tri koeficienty a, b, c , že bola získaná správna rovnica chemickej reakcie: A P2O5+ V H20= s H3PO4. Keďže rovnica využíva tri typy atómov, vytvoríme sústavu troch lineárnych rovníc s tromi neznámymi a, c A s .
Látky, ktoré boli použité pri chemickej reakcii: P – fosfor; O 2 – kyslík; P 2 O 5 – oxid fosforečný (V).
B) Fe2(S04)3 + KOH → Fe (OH)3 + K2S04.
Látky, ktoré boli použité pri chemickej reakcii: Fe 2 (SO 4) 3 – síran železitý; KOH – hydroxid draselný; Fe(OH) 3 – hydroxid železitý; K 2 SO 4 – síran draselný.
D) CuOH -> Cu20 + H20.
Riešenie: 2CuOH = Cu 2 O + H 2 O. Problém určenia číselných koeficientov bol vyriešený zostavením sústavy rovníc: 
Látky, ktoré boli použité pri chemickej reakcii: CuOH – hydroxid meďnatý; Cu 2 O – oxid meďnatý; H 2 O – voda.
D) CS2 + O2 → C02 + SO2.
Riešenie: CS2 + 302 = C02 + 2S02. Riešili sme výberom koeficientov: vyrovnali sme počet atómov síry (2); vyrovnal počet atómov kyslíka (3).
Látky, ktoré boli použité pri chemickej reakcii: CS 2 – sírnik (IV); O 2 –
Látky, ktoré boli použité pri chemickej reakcii: FeS 2 – pyrit; O 2 – kyslík; Fe 2 O 3 – oxid železitý; SO 2 - oxid sírový (IV).
Cvičenie 3.
(Bol navrhnutý na riešenie ako samostatná práca).
podmienka:
Napíšte rovnice chemických reakcií podľa nasledujúcich schém:
A) kyselina fosforečná + hydroxid sodný → fosforečnan sodný + voda;
B) oxid sodný + voda → hydroxid sodný;
B) oxid železitý + hliník → oxid hlinitý + železo;
D) hydroxid meďnatý → oxid meďnatý + voda.
odpoveď:
A) 2H3P04 + 6NaOH = 2Na3P04 + 6H20;
B) Na20 + H20 = 2NaOH;
B) 3FeO + 2Al = A1203 + 3Fe;
D) Cu(OH)2 = CuO + H20.
Za 10 minút 85 % študentov dokončilo úlohu „výborne“, čo Valentinu Ivanovnu príjemne prekvapilo.
Najjednoduchšia reakčná rovnica je:
Fe + S => FeS
Reakčnú rovnicu musíte vedieť nielen napísať, ale aj prečítať. Táto rovnica vo svojej najjednoduchšej forme znie takto: molekula železa interaguje s molekulou síry, čo vedie k jednej molekule sulfidu železa.
Najťažšie pri písaní reakčnej rovnice je vytvorenie vzorcov pre reakčné produkty, t.j. vytvorené látky. Existuje len jedno pravidlo: vzorce molekúl sú zostavené striktne podľa mocnosti ich základných prvkov.
Okrem toho pri zostavovaní reakčných rovníc je potrebné pamätať na zákon zachovania hmotnosti látok: všetky atómy molekúl východiskových látok musia byť zahrnuté do molekúl reakčných produktov. Ani jeden atóm by nemal zmiznúť alebo sa neočakávane objaviť. Preto niekedy po zapísaní všetkých vzorcov do reakčnej rovnice musíte vyrovnať počet atómov v každej časti rovnice - nastaviť koeficienty. Tu je príklad:
C + 02 => C02Tu má každý prvok rovnaký počet atómov na pravej aj ľavej strane rovnice. Rovnica je pripravená.
Cu+O 2 => CuO
A tu je viac atómov kyslíka na ľavej strane rovnice ako na pravej. Je potrebné získať toľko molekúl oxidu medi
CuO , aby obsahovali rovnaký počet atómov kyslíka, teda 2. Preto vzorecCuO nastaviť koeficient 2:Cu+O2 => 2 CuO
Teraz počet atómov medi nie je rovnaký. Na ľavú stranu rovnice pred medené znamienko dáme koeficient 2:
2 Cu + O2 => 2 CuO
Spočítajte, či je rovnaký počet atómov každého prvku na ľavej a pravej strane rovnice. Ak áno, potom je reakčná rovnica správna.
Ešte jeden príklad: Al+O 2 = Al 2 O 3
A tu sú rôzne počty atómov každého prvku pred a po reakcii. Začneme vyrovnávať plynom - molekulami kyslíka:
ostáva 1 2 atómy kyslíka a napravo sú 3. Hľadáme najmenší spoločný násobok týchto dvoch čísel. Toto je najmenšie číslo, ktoré je deliteľné 2 aj 3, teda 6. Pred vzorcami kyslíka a oxidu hlinitéhoAl 2 O 3 Nastavíme také koeficienty, aby celkový počet atómov kyslíka v týchto molekulách bol 6:
Al+ 302= 2 Al20 3
2) Počítame počet atómov hliníka: vľavo je 1 atóm a vpravo sú 2 atómy v dvoch molekulách, t.j. 4. Pred hliníkový znak na ľavej strane rovnice dáme koeficient 4:
4Al + 30 2 => 2 Al203
3) Ešte raz spočítame všetky atómy pred a po reakcii: každý 4 atómy hliníka a 6 atómov kyslíka.
Všetko je v poriadku, rovnica reakcie je správna. A ak k reakcii dôjde pri zahrievaní, potom je nad šípkou umiestnená dodatočná značka t.
Rovnica chemickej reakcie je záznam priebehu chemickej reakcie pomocou chemických vzorcov a koeficientov.






