A "" tanfolyam 13. leckében Kémia bábukhoz» fontolja meg, miért van szükség kémiai egyenletekre; Tanuljuk meg, hogyan lehet kiegyenlíteni a kémiai reakciókat az együtthatók helyes elrendezésével. Ez a lecke megköveteli, hogy ismerje az alapvető kémiát az előző leckékből. Feltétlenül olvassa el az elemanalízist az empirikus képletek és a kémiai elemzés alapos áttekintése érdekében.
A metán CH 4 oxigénben O 2 égési reakciója során szén-dioxid CO 2 és víz H 2 O képződik Ez a reakció leírható kémiai egyenlet:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Próbáljunk meg több információt kinyerni egy kémiai egyenletből, mint csupán jelzést termékek és reagensek reakciók. Az (1) kémiai egyenlet NEM teljes, ezért nem ad információt arról, hogy hány O 2 molekulát fogyasztunk 1 CH 4 molekulánként, és hány CO 2 és H2 O molekulát kapunk ennek eredményeként. De ha a megfelelő molekulaképletek elé numerikus együtthatókat írunk fel, amelyek azt jelzik, hogy az egyes típusokból hány molekula vesz részt a reakcióban, akkor azt kapjuk, teljes kémiai egyenlet reakciók.
Az (1) kémiai egyenlet összetételének teljessé tételéhez emlékezni kell egy egyszerű szabályra: az egyenlet bal és jobb oldalán azonos számú atomot kell tartalmaznia minden típusból, mivel a kémiai reakció során nem keletkeznek új atomok. létrejöttek és a meglévők nem semmisülnek meg. Ez a szabály a tömegmegmaradás törvényén alapul, amelyet a fejezet elején tárgyaltunk.
Ez szükséges ahhoz, hogy egy egyszerű kémiai egyenletből teljeset kapjunk. Tehát térjünk át az (1) reakció tényleges egyenletére: nézzük meg még egyszer a kémiai egyenletet, pontosan a jobb és bal oldalon lévő atomokat és molekulákat. Könnyen belátható, hogy a reakcióban háromféle atom vesz részt: szén C, hidrogén H és oxigén O. Számoljuk meg és hasonlítsuk össze az egyes típusok atomjainak számát a kémiai egyenlet jobb és bal oldalán.

Kezdjük a szénnel. A bal oldalon egy C atom a CH 4 molekula része, a jobb oldalon pedig egy C atom a CO 2 része. Így a bal és a jobb oldalon azonos a szénatomok száma, ezért hagyjuk békén. De az érthetőség kedvéért tegyünk egy 1-es együtthatót a szénnel rendelkező molekulák elé, bár ez nem szükséges:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Ezután áttérünk a H hidrogénatomok számlálására. A bal oldalon 4 H atom (kvantitatív értelemben H 4 = 4H) található a CH 4 molekulában, a jobb oldalon pedig csak 2 H atom található a CH 4 molekulában. H 2 O molekula, ami kétszer kevesebb, mint a (2) kémiai egyenlet bal oldalán. Egyenlítsünk! Ehhez tegyünk 2-es együtthatót a H 2 O molekula elé. Most 4 H hidrogén molekula lesz mind a reaktánsokban, mind a termékekben:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Kérjük, vegye figyelembe, hogy a 2-es együttható, amelyet a H 2 O vízmolekula elé írtunk a H hidrogén kiegyenlítésére, kétszeresére növeli az összetételében található összes atomot, azaz a 2H 2 O 4H-t és 2O-t jelent. Oké, úgy tűnik, ezt megoldottuk, csak meg kell számolni és összehasonlítani az O oxigénatomok számát a (3) kémiai egyenletben. Azonnal megakad a szemed, hogy a bal oldalon pontosan 2-szer kevesebb az O atom, mint a jobb oldalon. Most már tudja, hogyan kell kiegyensúlyozni a kémiai egyenleteket, ezért azonnal leírom a végeredményt:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O vagy CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Mint látható, a kémiai reakciók kiegyenlítése nem olyan trükkös dolog, és itt nem a kémia a fontos, hanem a matematika. A (4) egyenletet nevezzük teljes egyenlet kémiai reakció, mert betartja a tömegmegmaradás törvényét, azaz. az egyes típusú atomok száma, amelyek a reakcióba lépnek, pontosan egybeesik az ilyen típusú atomok számával a reakció befejeződése után. Ennek a teljes kémiai egyenletnek minden oldala 1 szénatomot, 4 hidrogénatomot és 4 oxigénatomot tartalmaz. Érdemes azonban megérteni néhány fontos dolgot: a kémiai reakció az egyes köztes szakaszok összetett sorozata, ezért például a (4) egyenlet nem értelmezhető úgy, hogy 1 metánmolekulának egyszerre kell ütköznie 2 oxigénnel. molekulák. A reakciótermékek képződése során fellépő folyamatok sokkal összetettebbek. A második pont: a reakció teljes egyenlete semmit sem mond el a molekuláris mechanizmusáról, vagyis a bekövetkezése során molekuláris szinten végbemenő események sorrendjéről.
Együtthatók kémiai reakcióegyenletekben
Egy másik világos példa a helyes elrendezésre esély kémiai reakcióegyenletekben: A trinitrotoluol (TNT) C 7 H 5 N 3 O 6 erőteljesen egyesül az oxigénnel, és H 2 O, CO 2 és N 2 keletkezik. Írjuk fel a reakcióegyenletet, amelyet kiegyenlítünk:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Könnyebb a teljes egyenlet összeállítása két TNT molekula alapján, mivel a bal oldalon páratlan számú hidrogén- és nitrogénatom található, a jobb oldalon pedig páros szám:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Akkor világos, hogy 14 szénatomnak, 10 hidrogénatomnak és 6 nitrogénatomnak 14 szén-dioxid molekulává, 5 vízmolekulává és 3 nitrogénmolekulává kell alakulnia:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Most mindkét rész azonos számú atomot tartalmaz, kivéve az oxigént. Az egyenlet jobb oldalán található 33 oxigénatomból 12-t a két eredeti TNT-molekula, a maradék 21-et pedig 10,5 O 2-molekulának kell ellátnia. Így a teljes kémiai egyenlet így fog kinézni:
- 2C 7 H 5 N 3 O 6 + 10,5 O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Mindkét oldalt megszorozhatja 2-vel, és megszabadulhat a 10,5 nem egész együtthatótól:
- 4C 7H 5N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
De ezt nem kell megtenni, mivel az egyenlet összes együtthatójának nem kell egész számnak lennie. Még helyesebb lenne egy egyenletet létrehozni egy TNT-molekula alapján:
- C 7 H 5 N 3 O 6 + 5,25 O 2 → 7CO 2 + 2,5 H 2 O + 1,5 N 2 (10)
A (9) teljes kémiai egyenlet sok információt tartalmaz. Először is jelzi a kiindulási anyagokat - reagensek, és Termékek reakciók. Ezenkívül azt mutatja, hogy a reakció során az egyes típusú atomok egyenként megmaradnak. Ha a (9) egyenlet mindkét oldalát megszorozzuk Avogadro-számmal, N A = 6,022 10 23, akkor kijelenthetjük, hogy 4 mol TNT reagál 21 mol O 2 -vel, így 28 mol CO 2, 10 mol H 2 O és 6 mol képződik. mol N2.
Van még egy trükk. A periódusos rendszer segítségével meghatározzuk ezeknek az anyagoknak a molekulatömegét:
- C7H5N3O6 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Most a 9. egyenlet azt is jelzi, hogy 4 227,13 g = 908,52 g TNT 21 31,999 g = 671,98 g oxigént igényel a reakció befejezéséhez, és ennek eredményeként 28 44,010 g = 1232,3 g CO 2 képződik, 1015,18 g = 1015,18. g H2O és 6,28,013 g = 168,08 g N2. Ellenőrizzük, hogy a tömegmegmaradás törvénye teljesül-e ebben a reakcióban:
| Reagensek | Termékek | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Teljes | 1580,5 g | 1580,5 g |
De az egyes molekuláknak nem feltétlenül kell részt venniük egy kémiai reakcióban. Például a mészkő CaCO3 és sósav HCl reakciója kalcium-klorid CaCl2 és szén-dioxid CO2 vizes oldatává:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
A (11) kémiai egyenlet leírja a kalcium-karbonát CaCO 3 (mészkő) és a sósav HCl reakcióját, melynek során kalcium-klorid CaCl 2 és szén-dioxid CO 2 vizes oldata keletkezik. Ez az egyenlet teljes, mivel az egyes típusok atomjainak száma a bal és a jobb oldalon azonos.
Ennek az egyenletnek a jelentése makroszkópos (moláris) szint a következő: 1 mól vagy 100,09 g CaCO 3-hoz 2 mól vagy 72,92 g HCl szükséges a reakció befejezéséhez, ami 1 mól CaCl 2-t (110,99 g/mol), CO 2-t (44,01 g/mol) és H 2-t eredményez. O (18,02 g/mol). Ezekből a numerikus adatokból könnyen ellenőrizhető, hogy ebben a reakcióban teljesül-e a tömegmegmaradás törvénye.
A (11) egyenlet értelmezése tovább mikroszkopikus (molekuláris) szinten nem annyira nyilvánvaló, mivel a kalcium-karbonát só, nem molekuláris vegyület, ezért a (11) kémiai egyenlet nem értelmezhető abban az értelemben, hogy 1 molekula kalcium-karbonát CaCO 3 reakcióba lép 2 molekula HCl-lel. Ezenkívül az oldatban lévő HCl molekula általában H + és Cl - ionokra disszociál (szétbomlik). Így pontosabban leírja, hogy mi történik ebben a reakcióban molekuláris szinten, az egyenlet:
- CaCO 3 (szol.) + 2H + (vizes) → Ca 2+ (vizes) + CO 2 (g.) + H 2 O (l.) (12)
Itt az egyes részecsketípusok fizikai állapotát röviden zárójelben jelezzük ( tévé- kemény, aq.- hidratált ion vizes oldatban, G.- gáz, és.- folyadék).
A (12) egyenlet azt mutatja, hogy a szilárd CaCO 3 reakcióba lép két hidratált H + ionnal, pozitív Ca 2+, CO 2 és H 2 O iont képezve. A (12) egyenlet más teljes kémiai egyenletekhez hasonlóan nem ad képet a A molekuláris mechanizmus reakciói, és kevésbé kényelmes az anyagok mennyiségének számlálása, viszont jobban leírja, mi történik mikroszkópos szinten.
Erősítse meg ismereteit a kémiai egyenletek összeállításával kapcsolatban úgy, hogy saját maga dolgozzon át egy példán egy megoldást:
Remélem a 13. leckétől" Kémiai egyenletek írása"Valami újat tanultál magadnak. Ha bármilyen kérdése van, írja meg őket a megjegyzésekben.
Algoritmus
Együtthatók elrendezése kémiai reakcióegyenletekben
MBOU 2. számú kémiatanár középiskola
Volodcsenko Szvetlana Nyikolajevna
Ussuriysk
A KÉMIAI REAKCIÓK EGYENLETEIBEN AZ EGYETTŐK ELHELYEZÉSE
Az egyenlet bal oldalán lévő elem atomjainak számának meg kell egyeznie az egyenlet jobb oldalán lévő elem atomjainak számával.
1. feladat (csoportoknak).Határozza meg a reakcióban részt vevő egyes kémiai elemek atomjainak számát!
1. Számítsa ki az atomok számát:
A) hidrogén: 8NH3, NaOH, 6NaOH, 2NaOH,NZRO4, 2H2SO4, 3H2S04, 8H2SO4;
6) oxigén: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Számítsa ki az atomok számát: a)hidrogén:
1) NaOH + HCl 2) CH4+H20 3) 2Na+H2
b) oxigén:
1) 2СО + 02 2) С02 + 2Н.О. 3) 4NO2 + 2H2O + O2
Algoritmus együtthatók elrendezésére kémiai reakcióegyenletekben
А1 + О2 → А12О3A1-1 atom A1-2
O-2 atom O-3
2. A diagram bal és jobb oldalán lévő különböző atomszámú elemek közül válassza ki azt, amelyiknek atomszáma nagyobb
O-2 atomok a bal oldalon
O-3 atomok a jobb oldalon
3. Keresse meg ennek az elemnek az atomjainak legkisebb közös többszörösét (LCM) az egyenlet bal oldalán és ennek az elemnek az atomszámát az egyenlet jobb oldalán
LCM = 6
4. Ossza el az LCM-et az egyenlet bal oldalán lévő elem atomjainak számával, és kapja meg az egyenlet bal oldalán lévő együtthatót
6:2 = 3
Al + ZO 2 →Al 2 RÓL RŐL 3
5. Ossza el az LCM-et az egyenlet jobb oldalán lévő elem atomjainak számával, és kapja meg az egyenlet jobb oldalán lévő együtthatót
6:3 = 2
A1+O 2 →2A1 2 O3
6. Ha a beállított együttható megváltoztatta egy másik elem atomszámát, ismételje meg újra a 3., 4., 5. lépéseket.
A1 + ZO 2 → →2А1 2 RÓL RŐL 3
A1-1 atom A1-4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → →2A1 2 RÓL RŐL 3
. Elsődleges ismeretszerzési teszt (8-10 perc .).
Két oxigénatom van a diagram bal oldalán, és egy a jobb oldalon. Az atomok számát együtthatók segítségével kell kiegyenlíteni.
1) 2Mg+O2 → 2MgO
2) CaCO3 + 2HCl→CaCl2 + N2 O + CO2
2. feladat Helyezze el az együtthatókat a kémiai reakciók egyenleteibe (megjegyzendő, hogy az együttható csak egy elem atomszámát változtatja meg):
1. Fe 2 O 3 + A l → A l 2 RÓL RŐL 3 + Fe; Mg+N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1+ VAL VEL → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr+Al 2 O 3 ; Ca+P → kb 3 P 2 ;
4. C + H 2 → CH 4 ; kb + C → SaS 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na+S → Na 2 S; CaO+ VAL VEL → CaC 2 + CO;
7.Ca+N 2 → C a 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; N 2 + VAL VEL l 2 → NS l;
9.N 2 + O 2 → NEM; CO 2 + VAL VEL → CO ;
10. HI → N 2 → + 1 2 ; Mg+ NS l → MgCl 2 + N 2 ;
11.FeS+ NS 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;
12. Br 2 +KI → KBr+I 2 ; Si+HF (r) → Szelektív azonosítási jelleg 4 +H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + VAL VEL → Si + CO;
15. SiO 2 + VAL VEL → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Mi a kémiai reakció egyenlete?
2.Mi van az egyenlet jobb oldalára írva? És a bal oldalon?
3. Mit jelent a „+” jel egy egyenletben?
4. Miért vannak együtthatók a kémiai egyenletekben?
Számos módszer létezik a redoxreakciók egyenleteinek együtthatóinak meghatározására. Elektronikus mérleg módszert alkalmazunk, amelyben a teljes OVR egyenlet összeállítása a következő sorrendben történik:
1. Készítsen reakciódiagramot, jelezve a reagált anyagokat és a reakcióból származó anyagokat, például:
2. Határozza meg az atomok oxidációs állapotát, és írja be annak jelét és értékét az elemek szimbólumai fölé, jegyezve meg azokat az elemeket, amelyek oxidációs állapota megváltozott:
3. Írja fel az oxidációs és redukciós reakciók elektronegyenleteit, határozza meg a redukálószer által leadott és az oxidálószer által elfogadott elektronok számát, majd a megfelelő együtthatók szorzásával egyenlítse ki őket!
4. Az elektronikus mérlegnek megfelelő kapott együtthatókat átvisszük a főegyenletbe:
5. Egyenlítse ki az oxidációs állapotot nem változtató atomok és ionok számát (sorrendben: fémek, nemfémek, hidrogén):
6. Ellenőrizze az együtthatók kiválasztásának helyességét a reakcióegyenlet bal és jobb oldalán lévő oxigénatomok száma alapján - egyenlőnek kell lenniük (ebben az egyenletben 24 = 18 + 2 + 4, 24 = 24).
Nézzünk egy bonyolultabb példát:
Határozzuk meg a molekulákban lévő atomok oxidációs állapotát:
Alkossunk elektronikus egyenleteket az oxidációs és redukciós reakciókra, és egyenlítsük ki az adott és az elfogadott elektronok számát:
Vigyük át az együtthatókat a főegyenletbe:
Kiegyenlítjük azon atomok számát, amelyek nem változtatják meg az oxidációs állapotot:
Ha megszámoljuk az oxigénatomok számát az egyenlet jobb és bal oldalán, megbizonyosodunk arról, hogy az együtthatók helyesen lettek kiválasztva.
A legfontosabb oxidáló és redukálószerek
Az elemek redox tulajdonságai az atomok elektronikus héjának szerkezetétől függenek, és a Mengyelejev-féle periódusos rendszerben elfoglalt helyzetük határozza meg.
A külső energiaszinten 1-3 elektront tartalmazó fémek könnyen feladják őket, és csak redukáló tulajdonságokat mutatnak. A nemfémek (IV-VII. csoportba tartozó elemek) elektronokat is tudnak adni és elfogadni, így redukáló és oxidáló tulajdonságokat is mutathatnak. Azokban az időszakokban, amikor az elem atomszáma megnövekszik, az egyszerű anyagok redukáló tulajdonságai gyengülnek, és az oxidáló tulajdonságok nőnek. A sorszám növekedésével rendelkező csoportokban a redukáló tulajdonságok nőnek, az oxidáló tulajdonságok gyengülnek. És így, egyszerű anyagok közül a legjobb redukálószerek az alkálifémek, alumínium, hidrogén, szén; a legjobb oxidálószerek a halogének és az oxigén.
Az összetett anyagok redox tulajdonságai az őket alkotó atomok oxidációs fokától függenek. A legalacsonyabb oxidációs állapotú atomokat tartalmazó anyagok redukáló tulajdonságokat mutatnak. A legfontosabb redukálószerek a szén-monoxid  , hidrogén-szulfid
, hidrogén-szulfid  , vas(II)-szulfát
, vas(II)-szulfát  .A legmagasabb oxidációs állapotú atomokat tartalmazó anyagok oxidáló tulajdonságokat mutatnak. A legfontosabb oxidálószerek a kálium-permanganát
.A legmagasabb oxidációs állapotú atomokat tartalmazó anyagok oxidáló tulajdonságokat mutatnak. A legfontosabb oxidálószerek a kálium-permanganát  , kálium-dikromát
, kálium-dikromát  , hidrogén-peroxid
, hidrogén-peroxid  , Salétromsav
, Salétromsav  , tömény kénsav
, tömény kénsav  .
.
A közbenső oxidációs állapotú atomokat tartalmazó anyagok oxidáló- vagy redukálószerként viselkedhetnek a kölcsönhatásba lépő anyagok tulajdonságaitól és a reakciókörülményektől függően. Tehát reakcióban  A kénsav redukáló tulajdonságokkal rendelkezik:
A kénsav redukáló tulajdonságokkal rendelkezik:
és ha hidrogén-szulfiddal kölcsönhatásba lép, oxidálószer:

Ezenkívül az ilyen anyagok esetében lehetségesek az önoxidációs-önredukciós reakciók, amelyek ugyanazon elem atomjainak oxidációs állapotának egyidejű növekedésével és csökkenésével járnak, például:
Számos oxidáló és redukálószer erőssége a közeg pH-jától függ. Például, 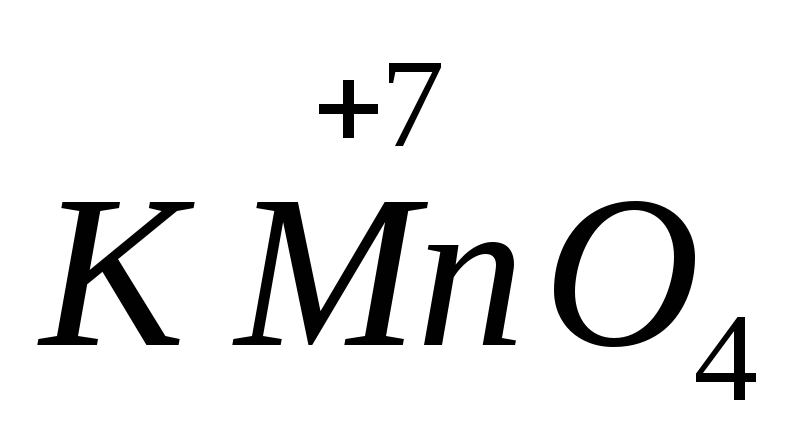 lúgos környezetben arra redukálódik
lúgos környezetben arra redukálódik  , semleges a
, semleges a  , kénsav jelenlétében - ig
, kénsav jelenlétében - ig  .
.
L  Könnyű együtthatókat elhelyezni kémiai egyenletekben?
Könnyű együtthatókat elhelyezni kémiai egyenletekben?
Tehát a gyerekeim felnőttek a kémiához (8. „B” osztályos osztályfőnök vagyok). A kémiát leggyakrabban az első órán tanítják a gyerekeknek, de csütörtökön nem volt az első órám, és megkértem, hogy menjek el Valentina Ivanovna órájára, hogy „nézzem a gyerekeket” és megnézzem a naplókat. A téma lenyűgözött az iskolában, szerettem a kémiát, és nem néztem meg a naplókat. Ismét meggyőződtem arról, hogy a hallgatók leggyakrabban abból adódnak nehézségek, hogy nem látnak interdiszciplináris összefüggéseket. Ezen a kémia órán a tanulóknak kémiai egyenleteket kellett készíteniük a vegyi anyagok vegyértéke alapján. És sok diáknak nehézséget okozott a numerikus együtthatók meghatározása. Valentina Ivanovna és én szombaton tartottuk együtt a következő kémiaóránkat.
1. Feladat.
Írd fel kémiai egyenletként a következő mondatokat:
A) „A kalcium-karbonát pörkölésekor kalcium-oxid és szén-monoxid (IV) képződik”; b) „Amikor a foszfor (V)-oxid reakcióba lép vízzel, foszforsavat kapunk.”
Megoldás:
A) CaCO 3 = CaO + CO 2 - a reakció endoterm. Ezzel a feladattal nem okozott nehézséget, hiszen nem kellett számszerű együtthatókat keresni. Kezdetben az egyenlet bal és jobb oldala egy kalcium-, egy szén- és három oxigénatomot tartalmaz.
B) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - a reakció exoterm. A második egyenlettel numerikus együtthatók nélkül nem sikerült a helyes egyenlőség: P 2 O 5 + H 2 O → H 3 PO 4 . Nyilvánvaló, hogy a helyes egyenlőség felállításához számszerű együtthatókat kell kiválasztani. Ha kiválasztja, kezdheti a foszforral: két atom van a bal oldalon és egy a jobb oldalon, így a salétromsav képlete elé teszünk egy kettővel egyenlő numerikus tényezőt, és ezt kapjuk: P 2 O 5 + H 20 → 2H3PO4. De most hátra van az oxigén- és hidrogénatomok számának kiegyenlítése: a bal oldalon két hidrogénatom, a jobb oldalon hat atom található, így a víz képlete elé teszünk egy hárommal egyenlő numerikus együtthatót, és ezt kapjuk: P 2 O 5 + 3H 2 O → 2H 3 PO 4. Most már könnyen ellenőrizhető, hogy az egyenlet minden részében egyenlő mennyiségű foszforatom, hidrogénatom és oxigénatom van, így megkaptuk a kémiai reakció helyes egyenletét: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
Második út: algebrai. Tegyük fel, hogy három együtthatót teszünk az egyenletbe a, b, c , hogy megkapjuk a kémiai reakció helyes egyenletét: A P2O5+ V H2O= Val vel H3PO4. Mivel az egyenlet háromféle atomot használ, létrehozunk egy három lineáris egyenletrendszert három ismeretlennel a, cÉs Val vel .
A kémiai reakcióban felhasznált anyagok: P – foszfor; O 2 – oxigén; P 2 O 5 – foszfor (V) oxid.
B) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
A kémiai reakcióban felhasznált anyagok: Fe 2 (SO 4) 3 – vas(III)-szulfát; KOH – kálium-hidroxid; Fe(OH) 3 – vas(III)-hidroxid; K 2 SO 4 – kálium-szulfát.
D) CuOH → Cu 2 O + H 2 O.
Megoldás: 2CuOH = Cu 2 O + H 2 O. A numerikus együtthatók meghatározásának problémáját egyenletrendszer összeállításával oldottuk meg: 
A kémiai reakcióban felhasznált anyagok: CuOH – réz(I)-hidroxid; Cu 2 O – réz(I)-oxid; H 2 O – víz.
D) CS 2 + O 2 → CO 2 + SO 2.
Megoldás: CS 2 + 3O 2 = CO 2 + 2SO 2. Koefficiensek kiválasztásával oldottuk meg: kiegyenlítettük a kénatomok számát (2); kiegyenlítette az oxigénatomok számát (3).
A kémiai reakcióban felhasznált anyagok: CS 2 – kén (IV) szulfid; O 2 –
A kémiai reakcióban felhasznált anyagok: FeS 2 – pirit; O 2 – oxigén; Fe 2 O 3 – vas(III)-oxid; SO 2 - kén-oxid (IV).
3. gyakorlat.
(Megoldásra külön munkaként javasolták).
Feltétel:
Írja fel a kémiai reakciók egyenleteit a következő sémák szerint:
A) foszforsav + nátrium-hidroxid → nátrium-foszfát + víz;
B) nátrium-oxid + víz → nátrium-hidroxid;
B) vas(II)-oxid + alumínium → alumínium-oxid + vas;
D) réz(II)-hidroxid → réz(II)-oxid + víz.
Válasz:
A) 2H3PO4 + 6NaOH = 2Na3PO4 + 6H20;
B) Na20 + H20 = 2NaOH;
B) 3FeO + 2Al = Al 2O 3 + 3Fe;
D) Cu(OH) 2 = CuO + H 2 O.
10 perc alatt a tanulók 85%-a „kitűnően” teljesítette a feladatot, ami kellemesen meglepte Valentina Ivanovnát.
A legegyszerűbb reakcióegyenlet:
Fe + S => FeS
A reakcióegyenletet nem csak felírni, hanem olvasni is tudni kell. Ez az egyenlet a legegyszerűbb formájában így hangzik: egy vasmolekula kölcsönhatásba lép egy kénmolekulával, ami egy molekula vas-szulfidot eredményez.
A reakcióegyenlet felírásakor a legnehezebb a reakciótermékek képleteinek elkészítése, pl. képződött anyagok. Itt egyetlen szabály van: a molekulák képlete szigorúan az alkotóelemeik vegyértéke szerint épül fel.
Ezenkívül a reakcióegyenletek elkészítésekor emlékezni kell az anyagok tömegének megmaradásának törvényére: a kiindulási anyagok molekuláinak minden atomját be kell foglalni a reakciótermékek molekuláiba. Egyetlen atom sem tűnhet el vagy jelenhet meg váratlanul. Ezért néha, miután az összes képletet felírta a reakcióegyenletbe, ki kell egyenlítenie az atomok számát az egyenlet minden részében - állítsa be az együtthatókat. Íme egy példa:
C + O 2 => CO 2Itt minden elemnek ugyanannyi atomja van az egyenlet jobb és bal oldalán is. Az egyenlet készen áll.
Cu+O 2 => CuO
És itt több oxigénatom van az egyenlet bal oldalán, mint a jobb oldalon. Annyi réz-oxid molekulát kell előállítani
CuO , hogy azonos számú oxigénatomot, azaz 2-t tartalmazzanak. Ezért a képletCuO 2. együttható beállítása:Cu+O2 => 2 CuO
Most a rézatomok száma nem azonos. Az egyenlet bal oldalán, a rézjel elé tesszük a 2-es együtthatót:
2 Cu + O2 => 2 CuO
Számold meg, hogy az egyenlet bal és jobb oldalán egyenlő számú atom van-e minden elemből! Ha igen, akkor a reakcióegyenlet helyes.
Még egy példa: Al+O 2 = Al 2 O 3
És itt minden elemnek különböző számú atomja van a reakció előtt és után. Elkezdjük a szintezést gázzal - oxigénmolekulákkal:
1 maradt 2 oxigénatom, a jobb oldalon pedig 3. Ennek a két számnak a legkisebb közös többszörösét keressük. Ez a legkisebb szám, amely osztható 2-vel és 3-mal is, azaz 6-tal. Az oxigén és az alumínium-oxid képlete előttAl 2 O 3 Az ilyen együtthatókat úgy állítjuk be, hogy ezekben a molekulákban az oxigénatomok teljes száma 6 legyen:
Al+ 3 O 2= 2 Al 2 O 3
2) Megszámoljuk az alumíniumatomok számát: a bal oldalon 1 atom, a jobb oldalon 2 atom található két molekulában, azaz 4. Az egyenlet bal oldalán lévő alumínium jel elé tesszük a 4-es együtthatót:
4Al + 3O 2 => 2 Al2O3
3) Még egyszer megszámoljuk az összes atomot a reakció előtt és után: 4 alumíniumatomot és 6 oxigénatomot.
Minden rendben van, a reakcióegyenlet helyes. És ha a reakció hevítéskor következik be, akkor egy további jelet helyeznek el a nyíl felett t.
A kémiai reakció egyenlete egy kémiai reakció előrehaladásának rögzítése kémiai képletek és együtthatók segítségével.






