U lekciji 13 "" iz kursa " Hemija za lutke» razmotriti zašto su potrebne hemijske jednačine; Naučimo kako izjednačiti kemijske reakcije pravilnim rasporedom koeficijenata. Ova lekcija će zahtijevati od vas da znate osnovnu hemiju iz prethodnih lekcija. Obavezno pročitajte o elementarnoj analizi za dubinski pogled na empirijske formule i hemijsku analizu.
Kao rezultat reakcije sagorijevanja metana CH 4 u kisiku O 2, nastaju ugljični dioksid CO 2 i voda H 2 O hemijska jednačina:
- CH 4 + O 2 → CO 2 + H 2 O (1)
Hajde da pokušamo da izvučemo više informacija iz hemijske jednačine nego samo indikacije proizvodi i reagensi reakcije. Hemijska jednadžba (1) je NEpotpuna i stoga ne pruža nikakvu informaciju o tome koliko se molekula O 2 potroši na 1 molekul CH 4 i koliko se molekula CO 2 i H2 O dobije kao rezultat. Ali ako zapišemo numeričke koeficijente ispred odgovarajućih molekularnih formula, koje pokazuju koliko molekula svake vrste učestvuje u reakciji, onda ćemo dobiti kompletna hemijska jednačina reakcije.
Da biste kompletirali sastav hemijske jednadžbe (1), morate zapamtiti jedno jednostavno pravilo: lijeva i desna strana jednačine moraju sadržavati isti broj atoma svake vrste, budući da tokom kemijske reakcije nema novih atoma stvoreni a postojeći se ne uništavaju. Ovo pravilo se zasniva na zakonu održanja mase, o kojem smo govorili na početku poglavlja.
Neophodan je da bi se iz jednostavne hemijske jednadžbe dobila potpuna. Dakle, prijeđimo na stvarnu jednadžbu reakcije (1): pogledajte još jednom hemijsku jednačinu, tačno na atome i molekule na desnoj i lijevoj strani. Lako je vidjeti da reakcija uključuje tri vrste atoma: ugljik C, vodonik H i kisik O. Hajde da izbrojimo i uporedimo broj atoma svake vrste na desnoj i lijevoj strani kemijske jednadžbe.

Počnimo s ugljikom. Na lijevoj strani, jedan C atom je dio molekule CH4, a na desnoj strani, jedan C atom je dio CO2. Dakle, na lijevoj i desnoj strani broj atoma ugljika je isti, pa ga ostavljamo na miru. Ali radi jasnoće, stavimo koeficijent 1 ispred molekula s ugljikom, iako to nije potrebno:
- 1CH 4 + O 2 → 1CO 2 + H 2 O (2)
Zatim prelazimo na brojanje atoma vodika H. Na lijevoj strani se nalaze 4 H atoma (u kvantitativnom smislu, H 4 = 4H) u molekuli CH 4, a na desnoj strani su samo 2 H atoma u molekuli H 2 O molekula, što je dva puta manje nego na lijevoj strani hemijske jednačine (2). Hajde da izjednačimo! Da bismo to učinili, stavimo koeficijent 2 ispred molekule H 2 O. Sada ćemo imati 4 molekule vodika H u reaktantima i proizvodima:
- 1CH 4 + O 2 → 1CO 2 + 2H 2 O (3)
Napominjemo da koeficijent 2, koji smo napisali ispred molekule vode H 2 O za izjednačavanje vodonika H, povećava 2 puta sve atome uključene u njegov sastav, odnosno 2H 2 O znači 4H i 2O. U redu, čini se da smo ovo riješili, ostaje samo da prebrojimo i uporedimo broj atoma kiseonika O u hemijskoj jednačini (3). Odmah vam pada u oči da je na lijevoj strani tačno 2 puta manje O atoma nego na desnoj. Sada već znate kako sami uravnotežiti kemijske jednadžbe, pa ću odmah zapisati konačni rezultat:
- 1CH 4 + 2O 2 → 1CO 2 + 2H 2 O ili CH 4 + 2O 2 → CO 2 + 2H 2 O (4)
Kao što vidite, izjednačavanje hemijskih reakcija i nije tako škakljiva stvar, a ovde nije važna hemija, već matematika. Jednačina (4) se zove potpuna jednačina hemijsku reakciju, jer se pridržava zakona održanja mase, tj. broj atoma svake vrste koji ulaze u reakciju tačno se poklapa sa brojem atoma ove vrste po završetku reakcije. Svaka strana ove potpune hemijske jednadžbe sadrži 1 atom ugljika, 4 atoma vodika i 4 atoma kisika. Međutim, vrijedi razumjeti nekoliko važnih točaka: kemijska reakcija je složen niz pojedinačnih međufaza, pa se, na primjer, jednačina (4) ne može tumačiti u smislu da se 1 molekula metana mora istovremeno sudariti s 2 kisika. molekule. Procesi koji se dešavaju tokom formiranja produkta reakcije su mnogo složeniji. Druga stvar: kompletna jednadžba reakcije nam ne govori ništa o njenom molekularnom mehanizmu, odnosno o slijedu događaja koji se dešavaju na molekularnom nivou tokom njenog nastanka.
Koeficijenti u jednadžbama hemijskih reakcija
Još jedan jasan primjer kako pravilno urediti kvote u jednačinama hemijskih reakcija: trinitrotoluen (TNT) C 7 H 5 N 3 O 6 se snažno kombinuje sa kiseonikom da bi formirao H 2 O, CO 2 i N 2. Zapišimo jednačinu reakcije koju ćemo izjednačiti:
- C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (5)
Lakše je konstruirati kompletnu jednačinu na osnovu dvije molekule TNT-a, jer lijeva strana sadrži neparan broj atoma vodika i dušika, a desna paran broj:
- 2C 7 H 5 N 3 O 6 + O 2 → CO 2 + H 2 O + N 2 (6)
Tada je jasno da se 14 atoma ugljika, 10 atoma vodika i 6 atoma dušika moraju pretvoriti u 14 molekula ugljičnog dioksida, 5 molekula vode i 3 molekula dušika:
- 2C 7 H 5 N 3 O 6 + O 2 → 14CO 2 + 5H 2 O + 3N 2 (7)
Sada oba dijela sadrže isti broj svih atoma osim kisika. Od 33 atoma kiseonika prisutnih na desnoj strani jednačine, 12 se napajaju dva originalna molekula TNT-a, a preostalih 21 mora davati 10,5 O 2 molekula. Tako će kompletna hemijska jednačina izgledati ovako:
- 2C 7 H 5 N 3 O 6 + 10,5O 2 → 14CO 2 + 5H 2 O + 3N 2 (8)
Možete pomnožiti obje strane sa 2 i riješiti se necjelobrojnog koeficijenta 10,5:
- 4C 7 H 5 N 3 O 6 + 21O 2 → 28CO 2 + 10H 2 O + 6N 2 (9)
Ali to ne mora biti učinjeno, pošto svi koeficijenti jednačine ne moraju biti cijeli brojevi. Još bi ispravnije bilo napraviti jednačinu zasnovanu na jednom molekulu TNT-a:
- C 7 H 5 N 3 O 6 + 5,25O 2 → 7CO 2 + 2,5H 2 O + 1,5N 2 (10)
Kompletna hemijska jednačina (9) sadrži mnogo informacija. Prije svega, to ukazuje na početne tvari - reagensi, i proizvodi reakcije. Osim toga, pokazuje da su tijekom reakcije svi atomi svake vrste pojedinačno očuvani. Ako pomnožimo obje strane jednačine (9) s Avogadrovim brojem N A = 6,022 10 23, možemo reći da 4 mola TNT-a reaguju sa 21 molom O2 i formiraju 28 molova CO2, 10 molova H2O i 6 molovi N 2.
Postoji još jedan trik. Pomoću periodnog sistema određujemo molekularne mase svih ovih supstanci:
- C 7 H 5 N 3 O 6 = 227,13 g/mol
- O2 = 31,999 g/mol
- CO2 = 44,010 g/mol
- H2O = 18,015 g/mol
- N2 = 28,013 g/mol
Sada će jednadžba 9 također pokazati da 4 227,13 g = 908,52 g TNT-a zahtijeva 21 31,999 g = 671,98 g kisika da završi reakciju i kao rezultat se formira 28 44,010 g = 1232,3 g CO 2, 1015·18 = 18. g H2O i 6·28,013 g = 168,08 g N2. Provjerimo da li je zakon održanja mase zadovoljen u ovoj reakciji:
| Reagensi | Proizvodi | |
| 908,52 g TNT | 1232,3 g CO2 | |
| 671,98 g CO2 | 180,15 g H2O | |
| 168,08 g N2 | ||
| Ukupno | 1580,5 g | 1580,5 g |
Ali pojedinačni molekuli ne moraju nužno sudjelovati u kemijskoj reakciji. Na primjer, reakcija vapnenca CaCO3 i hlorovodonične kiseline HCl da nastane vodena otopina kalcijevog klorida CaCl2 i ugljičnog dioksida CO2:
- CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O (11)
Hemijska jednadžba (11) opisuje reakciju kalcijum karbonata CaCO 3 (vapnenac) i hlorovodonične kiseline HCl da nastane vodeni rastvor kalcijum hlorida CaCl 2 i ugljen dioksida CO 2. Ova jednadžba je potpuna, jer je broj atoma svake vrste na lijevoj i desnoj strani isti.
Značenje ove jednačine je makroskopski (molarni) nivo je kako slijedi: 1 mol ili 100,09 g CaCO 3 zahtijeva 2 mola ili 72,92 g HCl da završi reakciju, što rezultira 1 molom CaCl 2 (110,99 g/mol), CO 2 (44,01 g/mol) i H 2 O (18,02 g/mol). Iz ovih numeričkih podataka lako je potvrditi da je zakon održanja mase zadovoljen u ovoj reakciji.
Tumačenje jednačine (11) na mikroskopski (molekularni) nivo nije tako očigledno, budući da je kalcijum karbonat sol, a ne molekularno jedinjenje, pa se stoga hemijska jednačina (11) ne može razumjeti u smislu da 1 molekul kalcijum karbonata CaCO 3 reaguje sa 2 molekula HCl. Štaviše, molekul HCl u rastvoru generalno se disocira (raspada) na H + i Cl - jone. Dakle, tačniji opis onoga što se dešava u ovoj reakciji na molekularnom nivou daje jednačina:
- CaCO 3 (sol.) + 2H + (aq.) → Ca 2+ (aq.) + CO 2 (g.) + H 2 O (l.) (12)
Ovdje je fizičko stanje svake vrste čestice ukratko naznačeno u zagradama ( TV- teško, aq.- hidratisani joni u vodenom rastvoru, G.- plin, i.- tečnost).
Jednačina (12) pokazuje da čvrsti CaCO 3 reaguje sa dva hidratizovana iona H +, formirajući pozitivne jone Ca 2+, CO 2 i H 2 O. Jednačina (12), kao i druge potpune hemijske jednadžbe, ne daje ideju o molekularni mehanizam reaguje i manje je pogodan za brojanje količine supstanci, međutim, daje bolji opis onoga što se dešava na mikroskopskom nivou.
Pojačajte svoje znanje o sastavljanju hemijskih jednadžbi tako što ćete sami raditi kroz primjer s rješenjem:
Nadam se od lekcije 13" Pisanje hemijskih jednadžbi„Naučio si nešto novo za sebe. Ako imate pitanja, napišite ih u komentarima.
Algoritam
Raspored koeficijenata u jednačinama hemijskih reakcija
Nastavnik hemije MBOU SŠ br.2
Volodčenko Svetlana Nikolajevna
Ussuriysk
UREĐENJE KOEFICIJENATA U JEDNAČINAMA HEMIJSKIH REAKCIJA
Broj atoma jednog elementa na lijevoj strani jednačine mora biti jednak broju atoma tog elementa na desnoj strani jednačine.
Zadatak 1 (za grupe).Odredite broj atoma svakog hemijskog elementa koji učestvuje u reakciji.
1. Izračunajte broj atoma:
A) vodonik: 8NH3, NaOH, 6NaOH, 2NaOH,NZRO4, 2H2SO4, 3H2S04, 8H2SO4;
6) kiseonik: C02, 3C02, 2C02, 6CO, H2SO4, 5H2SO4, 4H2S04, HN03.
2. Izračunajte broj atoma: a)vodonik:
1) NaOH + HCl 2)CH4+H20 3)2Na+H2
b) kiseonik:
1) 2SO + 02 2) S02 + 2N.O. 3)4NO2 + 2H2O + O2
Algoritam za sređivanje koeficijenata u jednačinama hemijskih reakcija
A1 + O2→ A12O3A1-1 atom A1-2
O-2 atom O-3
2. Među elementima s različitim brojem atoma u lijevom i desnom dijelu dijagrama odaberite onaj čiji je broj atoma veći
O-2 atomi na lijevoj strani
O-3 atomi na desnoj strani
3. Pronađite najmanji zajednički umnožak (LCM) broja atoma ovog elementa na lijevoj strani jednačine i broja atoma ovog elementa na desnoj strani jednačine
LCM = 6
4. Podijelite LCM brojem atoma ovog elementa na lijevoj strani jednačine, dobijete koeficijent za lijevu stranu jednačine
6:2 = 3
Al + ZO 2 →Al 2 O 3
5. Podijelite LCM sa brojem atoma ovog elementa na desnoj strani jednačine, dobijete koeficijent za desnu stranu jednačine
6:3 = 2
A1+ O 2 →2A1 2 O3
6. Ako je postavljeni koeficijent promijenio broj atoma drugog elementa, ponovite korake 3, 4, 5 ponovo.
A1 + ZO 2 → →2A1 2 O 3
A1 -1 atom A1 - 4
LCM = 4
4:1=4 4:4=1
4A1 + ZO 2 → →2A1 2 O 3
. Primarni test usvojenosti znanja (8-10 min .).
Na lijevoj strani dijagrama nalaze se dva atoma kisika, a na desnoj jedan. Broj atoma se mora izjednačiti pomoću koeficijenata.
1)2Mg+O2 →2MgO
2) CaCO3 + 2HCl→CaCl2 + N2 O + CO2
Zadatak 2 Stavite koeficijente u jednadžbe hemijskih reakcija (imajte na umu da koeficijent mijenja broj atoma samo jednog elementa):
1. Fe 2 O 3 + A l → A l 2 O 3 + Fe; Mg+N 2 → Mg 3 N 2 ;
2. Al + S → Al 2 S 3 ; A1+ WITH → Al 4 C 3 ;
3. Al + Cr 2 O 3 → Cr+Al 2 O 3 ; Ca+P → Ca 3 P 2 ;
4. C + H 2 → CH 4 ; Ca + C → SaS 2 ;
5. Fe + O 2 → Fe 3 O 4 ; Si + Mg → Mg 2 Si;
6/.Na+S → N / A 2 S; CaO+ WITH → CaC 2 + CO;
7.Ca+N 2 → C a 3 N 2 ; Si+Cl 2 → SiCl 4 ;
8. Ag+S → Ag 2 S; N 2 + WITH l 2 → NS l;
9.N 2 + O 2 → NE; CO 2 + WITH → CO ;
10. HI → N 2 → + 1 2 ; Mg+ NS l → MgCl 2 + N 2 ;
11.FeS+ NS 1 → FeCl 2 +H 2 S; Zn+HCl → ZnCl 2 +H 2 ;
12. Br 2 +KI → KBr+ I 2 ; Si+HF (r) → SiF 4 +H 2 ;
1./ HCl+Na 2 CO 3 → CO 2 +H 2 O+ NaCl; KClO 3 +S → → KCl+SO 2 ;
14. Cl 2 + KBr → KCl + Br 2 ; SiO 2 + WITH → Si + CO;
15. SiO 2 + WITH → SiC + CO; Mg + SiO 2 → Mg 2 Si + MgO
16. Mg 2 Si + HCl → MgCl 2 + SiH 4
1.Šta je jednačina hemijske reakcije?
2.Šta piše na desnoj strani jednačine? A na lijevoj strani?
3.Šta znači znak “+” u jednačini?
4. Zašto se koeficijenti stavljaju u hemijske jednačine?
Postoji nekoliko metoda za određivanje koeficijenata u jednadžbi redoks reakcija. Koristimo metodu elektronske ravnoteže, u kojoj se kompilacija kompletne OVR jednačine vrši u sljedećem redoslijedu:
1. Nacrtajte dijagram reakcije, navodeći tvari koje su reagirale i tvari nastale reakcijom, na primjer:
2. Odrediti oksidaciono stanje atoma i upisati njegov znak i vrijednost iznad simbola elemenata, zabilježeći elemente čije se oksidacijsko stanje promijenilo:
3. Zapišite elektronske jednadžbe za reakcije oksidacije i redukcije, odredite broj elektrona doniranih od strane redukcionog agensa i prihvaćenih od strane oksidansa, a zatim ih izjednačite množenjem odgovarajućim koeficijentima:
4. Dobijeni koeficijenti koji odgovaraju elektronskom bilansu prenose se u glavnu jednačinu:
5. Izjednačiti broj atoma i jona koji ne mijenjaju oksidacijsko stanje (po redoslijedu: metali, nemetali, vodonik):
6. Provjerite ispravnost odabira koeficijenata na osnovu broja atoma kisika na lijevoj i desnoj strani jednačine reakcije - oni bi trebali biti jednaki (u ovoj jednačini 24 = 18 + 2 + 4, 24 = 24).
Pogledajmo složeniji primjer:
Odredimo oksidaciona stanja atoma u molekulima:
Napravimo elektronske jednadžbe za reakcije oksidacije i redukcije i izjednačimo broj datih i prihvaćenih elektrona:
Prenesimo koeficijente u glavnu jednačinu:
Izjednačimo broj atoma koji ne mijenjaju oksidacijsko stanje:
Brojeći broj atoma kisika na desnoj i lijevoj strani jednadžbe, uvjerit ćemo se da su koeficijenti pravilno odabrani.
Najvažniji oksidacijski i redukcijski agensi
Redox svojstva elemenata zavise od strukture elektronske ljuske atoma i određena su njihovim položajem u periodnom sistemu Mendeljejeva.
Metali, koji imaju 1-3 elektrona na vanjskom energetskom nivou, lako ih se odriču i pokazuju samo redukciona svojstva. Nemetali (elementi grupa IV-VII) mogu i donirati i prihvatiti elektrone, tako da mogu pokazivati i redukciona i oksidirajuća svojstva. U periodima s povećanjem atomskog broja elementa, redukujuća svojstva jednostavnih tvari slabe, a oksidirajuća svojstva se povećavaju. U grupama sa povećanjem rednog broja povećavaju se redukciona svojstva, a slabe oksidaciona svojstva. dakle, od jednostavnih supstanci, najbolji redukcioni agensi su alkalni metali, aluminijum, vodonik, ugljenik; najbolji oksidanti su halogeni i kiseonik.
Redox svojstva složenih tvari zavise od stupnja oksidacije atoma koji ih čine. Supstance koje sadrže atome sa najnižim oksidacionim stanjem pokazuju redukciona svojstva. Najvažniji redukcioni agensi su ugljen monoksid  , hidrogen sulfid
, hidrogen sulfid  , gvožđe(II) sulfat
, gvožđe(II) sulfat  .Tvari koje sadrže atome s najvišim oksidacijskim stanjem pokazuju oksidirajuća svojstva. Najvažniji oksidanti su kalijum permanganat
.Tvari koje sadrže atome s najvišim oksidacijskim stanjem pokazuju oksidirajuća svojstva. Najvažniji oksidanti su kalijum permanganat  , kalijum dihromat
, kalijum dihromat  , vodikov peroksid
, vodikov peroksid  , Azotna kiselina
, Azotna kiselina  , koncentrovana sumporna kiselina
, koncentrovana sumporna kiselina  .
.
Tvari koje sadrže atome sa srednjim oksidacionim stanjima mogu se ponašati kao oksidacijski ili redukcijski agensi zavisno od svojstava supstanci sa kojima su u interakciji i uslova reakcije. Dakle u reakciji sa  sumporna kiselina pokazuje redukciona svojstva:
sumporna kiselina pokazuje redukciona svojstva:
a kada je u interakciji sa sumporovodikom, on je oksidant:

Osim toga, za takve tvari moguće su reakcije samooksidacije-samoredukcije, koje se javljaju uz istovremeno povećanje i smanjenje oksidacijskog stanja atoma istog elementa, na primjer:
Snaga mnogih oksidacijskih i redukcijskih sredstava ovisi o pH vrijednosti medija. Na primjer, 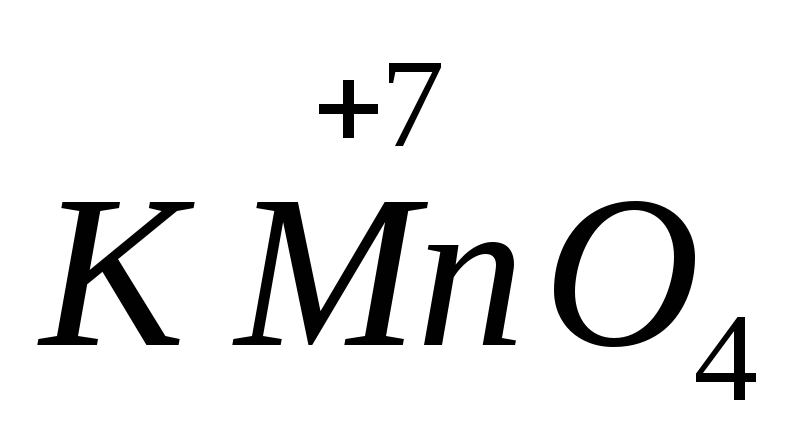 u alkalnoj sredini se svodi na
u alkalnoj sredini se svodi na  , u neutralnom do
, u neutralnom do  , u prisustvu sumporne kiseline - do
, u prisustvu sumporne kiseline - do  .
.
L  Da li je lako postaviti koeficijente u hemijske jednačine?
Da li je lako postaviti koeficijente u hemijske jednačine?
Tako su moja djeca dorasla hemiji (ja sam razrednik u 8. B razredu). Hemija se najčešće uči djeci na prvom času, ali u četvrtak nisam imala prvu lekciju, pa sam zamolila da odem na čas Valentine Ivanovne da "pogledam djecu" i provjerim dnevnike. Tema me je fascinirala. U školi sam volio hemiju, a dnevnike nisam provjeravao. Još jednom sam se uvjerio da studenti najčešće imaju poteškoća zbog činjenice da ne vide interdisciplinarne veze. U ovoj lekciji hemije od učenika se tražilo da naprave hemijske jednačine na osnovu valencije hemikalija. Mnogi učenici su imali poteškoća u određivanju brojčanih koeficijenata. Valentina Ivanovna i ja imali smo sljedeći čas hemije u subotu zajedno.
Vježba 1.
Napišite sljedeće rečenice kao hemijske jednačine:
A) “Kada se kalcijum karbonat prži, nastaju kalcijum oksid i ugljen monoksid (IV)”; b) "Kada fosfor (V) oksid reaguje s vodom, dobija se fosforna kiselina."
Rješenje:
A) CaCO 3 = CaO + CO 2 - reakcija je endotermna. S ovim zadatkom nije bilo poteškoća, jer nije bilo potrebe tražiti numeričke koeficijente. U početku, lijeva i desna strana jednadžbe sadrže jedan atom kalcija, jedan atom ugljika i tri atoma kisika.
B) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - reakcija je egzotermna. Bilo je problema sa drugom jednačinom bez numeričkih koeficijenata, tačna jednakost nije uspjela: P 2 O 5 + H 2 O → H 3 PO 4 . Očigledno, da biste napravili ispravnu jednakost, morate odabrati numeričke koeficijente. Ako odaberete, možete početi od fosfora: dva su atoma lijevo, a jedan desno, pa ispred formule dušične kiseline stavljamo brojčani faktor jednak dva i onda dobijemo: P 2 O 5 + H 2 O → 2H 3 PO 4 . Ali sada ostaje da izjednačimo broj atoma kisika i vodika: lijevo su dva atoma vodika, a desno šest atoma, pa ispred formule vode stavljamo numerički koeficijent jednak tri i onda dobijemo: P 2 O 5 + 3H 2 O → 2H 3 PO 4. Sada je lako provjeriti da u svakom dijelu jednačine postoje jednake količine atoma fosfora, atoma vodika i atoma kisika, stoga smo dobili tačnu jednačinu kemijske reakcije: P 2 O 5 + 3H 2 O = 2H 3 PO 4.
Drugi način: algebarski. Pretpostavimo da smo stavili tri koeficijenta u jednačinu a, b, c , da je dobijena ispravna jednačina hemijske reakcije: A P2O5+ V H2O= With H3PO4. Pošto jednačina koristi tri vrste atoma, napravićemo sistem od tri linearne jednadžbe sa tri nepoznate a, c I With .
Supstance koje su korišćene u hemijskoj reakciji: P – fosfor; O 2 – kiseonik; P 2 O 5 – fosfor (V) oksid.
B) Fe 2 (SO 4) 3 + KOH → Fe (OH) 3 + K 2 SO 4.
Supstance koje su korišćene u hemijskoj reakciji: Fe 2 (SO 4) 3 – gvožđe (III) sulfat; KOH – kalijum hidroksid; Fe(OH) 3 – gvožđe (III) hidroksid; K 2 SO 4 – kalijum sulfat.
D) CuOH → Cu 2 O + H 2 O.
Rješenje: 2CuOH = Cu 2 O + H 2 O. Problem određivanja numeričkih koeficijenata riješen je sastavljanjem sistema jednadžbi: 
Supstance koje su korišćene u hemijskoj reakciji: CuOH – bakar (I) hidroksid; Cu 2 O – bakar (I) oksid; H 2 O – voda.
D) CS 2 + O 2 → CO 2 + SO 2.
Rješenje: CS 2 + 3O 2 = CO 2 + 2SO 2. Rješavali smo odabirom koeficijenata: izjednačili smo broj atoma sumpora (2); izjednačio broj atoma kiseonika (3).
Supstance koje su korišćene u hemijskoj reakciji: CS 2 – sumpor (IV) sulfid; O 2 –
Supstance koje su korišćene u hemijskoj reakciji: FeS 2 – pirit; O 2 – kiseonik; Fe 2 O 3 – gvožđe (III) oksid; SO 2 - sumporov oksid (IV).
Vježba 3.
(Predloženo je za rješenje kao poseban rad).
Stanje:
Zapišite jednadžbe hemijskih reakcija prema sljedećim shemama:
A) fosforna kiselina + natrijum hidroksid → natrijum fosfat + voda;
B) natrijum oksid + voda → natrijum hidroksid;
B) gvožđe (II) oksid + aluminijum → aluminijum oksid + gvožđe;
D) bakar (II) hidroksid → bakar (II) oksid + voda.
odgovor:
A) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
B) Na 2 O + H 2 O = 2NaOH;
B) 3FeO + 2Al = Al 2 O 3 + 3Fe;
D) Cu(OH) 2 = CuO + H 2 O.
Za 10 minuta, 85% učenika je završilo zadatak „odlično“, što je prijatno iznenadilo Valentinu Ivanovnu.
Najjednostavnija jednačina reakcije je:
Fe + S => FeS
Morate biti u stanju ne samo napisati jednačinu reakcije, već je i pročitati. Ova jednadžba, u svom najjednostavnijem obliku, glasi ovako: molekul željeza stupa u interakciju s molekulom sumpora, što rezultira jednim molekulom željeznog sulfida.
Najteže u pisanju jednačine reakcije je kreiranje formula za produkte reakcije, tj. formirane supstance. Ovdje postoji samo jedno pravilo: formule molekula su građene striktno prema valencu njihovih sastavnih elemenata.
Osim toga, kada se sastavljaju jednadžbe reakcije, mora se zapamtiti zakon održanja mase tvari: svi atomi molekula polaznih tvari moraju biti uključeni u molekule produkta reakcije. Niti jedan atom ne bi trebao nestati ili se pojaviti neočekivano. Stoga, ponekad, nakon što ste napisali sve formule u jednadžbi reakcije, morate izjednačiti broj atoma u svakom dijelu jednadžbe - postaviti koeficijente. Evo primjera:
C + O 2 => CO 2Ovdje svaki element ima isti broj atoma i na desnoj i na lijevoj strani jednačine. Jednačina je spremna.
Cu+O 2 => CuO
I ovdje ima više atoma kisika na lijevoj strani jednadžbe nego na desnoj. Potrebno je dobiti toliko molekula bakrenog oksida
CuO , tako da sadrže isti broj atoma kiseonika, tj. 2. Dakle, formulaCuO postavljeni koeficijent 2:Cu+O2 => 2 CuO
Sada broj atoma bakra nije isti. Na lijevoj strani jednačine, ispred znaka bakra stavljamo koeficijent 2:
2 Cu + O2 => 2 CuO
Izračunajte da li postoji jednak broj atoma svakog elementa na lijevoj i desnoj strani jednačine. Ako da, onda je jednadžba reakcije tačna.
Još jedan primjer: Al+O 2 = Al 2 O 3
I ovdje postoje različiti brojevi atoma svakog elementa prije i poslije reakcije. Počinjemo izravnavanje plinom - molekulama kisika:
1) lijevo 2 atoma kiseonika, a desno je 3. Tražimo najmanji zajednički višekratnik ova dva broja. Ovo je najmanji broj koji je djeljiv i sa 2 i sa 3, tj. 6. Prije formula kisika i aluminijevog oksidaAl 2 O 3 Takve koeficijente postavljamo tako da ukupan broj atoma kisika u ovim molekulima bude 6:
Al+ 3 O 2= 2 Al 2 O 3
2) Brojimo broj atoma aluminija: lijevo je 1 atom, a desno 2 atoma u dva molekula, tj. 4. Ispred aluminijskog znaka na lijevoj strani jednačine stavljamo koeficijent 4:
4Al + 3O 2 => 2 Al2O3
3) Još jednom brojimo sve atome prije i poslije reakcije: po 4 atoma aluminija i 6 atoma kisika.
Sve je u redu, jednačina reakcije je tačna. A ako se reakcija dogodi kada se zagrije, tada se iznad strelice postavlja dodatni znak t.
Jednačina hemijske reakcije je zapis napredovanja hemijske reakcije pomoću hemijskih formula i koeficijenata.






