Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Скачать:
Предварительный просмотр:
Статья по химии: «Расстановка коэффициентов в химических уравнениях»
Составила: учитель химии
ГБОУ СОШ № 626
Казутина О.П.
Москва 2012
«Расстановка коэффициентов в химических уравнениях»
Преподаватель, являясь главным действующим лицом в организации познавательной деятельности учащихся, постоянно находится в поиске путей повышения эффективности обучения. Организация эффективного обучения возможна только при знании и умелом использовании разнообразных форм педагогического процесса.
1. Современный человек должен обладать, не только суммой знаний и умений, но и способностью воспринимать мир как единое, сложное, постоянно развивающееся целое.
Алгоритм работы по подготовке к проведению урока
выбор темы, определение целеполагания;
отбор содержания;
определение средств и путей развития у учащихся положительной мотивационной установки к работе на уроке;
конкретизация оснащения урока необходимым наглядным и дидактическим материалом;
разработка конспекта урока
Пример урока химии «Расстановка коэффициентов в химическом уравнении» для учителей
Цель: ответить на вопрос: «для чего надо расставлять коэффициенты в химическом уравнении»
Задачи:
Проблема необходимости расстановки коэффициентов
Алгоритм расстановки коэффициентов
Доказательство смысла расстановки коэффициентов
Ход урока:
Современный ученик, если он и учится, то относится к получаемым и перерабатываемым знаниям с прагматичностью. Поэтому предоставляемый материал должен уложиться в голове логично и лаконично.
Чтобы этого добиться, учителю всегда следует обращать внимание на то, зачем надо усвоить на уроке то или иное действие. То есть учитель должен объяснить. А потом, по – хорошему, дождаться правильных вопросов по новой теме.
Закон сохранения массы веществ
Знаменитый английский химик Р. Бойль, прокаливая в открытой реторте различные металлы и взвешивания их до и после нагревания, обнаружил, что масса металлов становится больше. Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в результате химических реакций изменяется. Р. Бойль утверждал, что существует какая-то "огненная материя", которая в случае нагревания металла соединяется с металлом, увеличивая массу.
Mg + O 2 MgO
24 г
40 г
М. В. Ломоносов в отличие от Р. Бойля прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается без изменения и что при прокаливании к металлу присоединяется какая-то часть воздуха. (Кислород в то время не был еще открыт.) Результаты этих опытов он сформулировал в виде закона: "Все перемены,в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается столько присовокупится к другому". В настоящее время этот закон формулируется так:
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
Mg + O 2 MgO
24 г 32 г 40 г
Вопрос: закон не выполняется (т.к. не равны массы исходных и конечных веществ).
Решение этой проблемы – расстановка коэффициентов (целых чисел, показывающих количество молекул):
2Mg + O 2 2MgO
48 г 32 г 80 г – массы до и после равны благодаря тому, что число атомов элементов тоже равно до и после реакции.
Таким образом, доказав учащимся необходимость уравнивания масс коэффициентов, можно даже обойтись без некоторых предыдущих тем: составления формул веществ по валентности, расчета массы, количество вещества…Также рассказ о том, что закон сохранения массы вещества 20 лет спустя «переоткрыл» А. Лавуазье, уточнив его с одной стороны, но совершенно не обратив внимания на М.В. Ломоносова с этической, можно оставить на самостоятельное изучение в виде доклада, например.
Итак, для успешного выполнения заданий такого рода, необходимо усвоить условие: число атомов до реакции дб равно числу атомов после реакции: решим вместе:
H 2 S + 3O 2 SO 2 + 2H 2 O (удваиваем кислороды справа. Считаем их слева)
СН 4 + 2О 2 СО 2 + 2Н 2 О
Мы расставили коэффициенты в уравнениях горения двух газов
Инструкция
Прежде чем приступать к самому заданию, нужно усвоить, что цифра, которая ставится перед химическим элементом или всей формулой коэффициентом. А цифра, стоящая (и чуть ) индекс. Кроме этого , что:
Коэффициент относится ко всем химическим символам, стоящим после него в формуле
Коэффициент умножается на индекс (не складывается!)
Атомов каждого элемента вступающих в реакцию веществ должно совпадать с числом атомов этих элементов, входящих в продуктов реакции.
Например, запись формулы 2H2SO4 означает 4 атома H (водорода), 2 атома S (серы) и 8 атомов O (кислорода).
1. Пример № 1. Рассмотрим горения этилена.
При сгорании органического вещества образуются оксид углерода (IV) (углекислый газ) и вода. Попробуем последовательно коэффициенты.
C2H4 + O2 => CO2+ H2O
Начинаем анализировать. В реакцию в ступило 2 атома С (углерода), а получился только 1 атом, значит перед CO2 ставим 2. Теперь их количество одинаково.
C2H4 + O2 => 2CO2+ H2O
Теперь смотрим на H (водород). В реакцию вступило 4 атома водорода, а получилось в результате только 2 атома, следовательно, перед H2O (водой) ставим 2 – теперь получилось тоже 4
C2H4 + O2 => 2CO2+ 2H2O
Считаем все атомы О (кислорода), образовавшиеся в результате реакции (то есть, после равенства). 4 атома в 2CO2 и 2 атома в 2H2O – всего 6 атомов. А до реакции всего 2 атома, значит, перед молекулой кислорода O2 ставим 3, а значит, их стало тоже 6.
C2H4 + 3O2 => 2CO2+ 2H2O
Таким образом, получилось одинаковое количество атомов каждого элемента до и после знака равенства.
C2H4 + 3O2 => 2CO2+ 2H2O
2. Пример № 2. Рассмотрим реакцию взаимодействия алюминия с разбавленной серной кислотой.
Al + H2SO4 => Al2 (SO4) 3 + H2
Смотрим на атомы S, входящие в состав Al2 (SO4) 3 - их 3, а в H2SO4 (серной кислоте) только 1, следовательно, и перед серной кислотой тоже ставим 3.
Al + 3H2SO4 => Al2 (SO4) 3 + H2
Зато теперь получилось до реакции 6 атомов H (водорода), а после реакции только 2, значит, перед молекулой H2 (водорода) ставим тоже 3, чтобы в целом получилось 6.
Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
В последнюю очередь смотрим на . Так как в Al2 (SO4) 3 (сульфате алюминия) всего 2 атома алюминия, то и до реакции перед Al (алюминием) ставим 2.
2Al + 3H2SO4 => Al2 (SO4) 3 + 3H2
Теперь количество всех атомов до и после реакции совпадает. Оказалось, что расставлять коэффициенты в химических уравнениях не так и сложно. Достаточно потренироваться и все получится.
Полезный совет
Обязательно учитывайте, что коэффициент умножается на индекс, а не складывается.
Источники:
- как элементы вступают в реакцию
- Тест по теме «Химические уравнения»
Для многих школьников написать уравнения химических реакций и правильно расставить коэффициенты нелегкая задача. Причем, главную трудность у них почему-то вызывает именно вторая ее часть. Казалось бы, ничего сложного в том нет, однако порой ученики пасуют, впадая в полную растерянность. А ведь надо всего лишь запомнить несколько простых правил, и задача перестанет вызывать затруднения.
Инструкция
Коэффициент, то есть число, стоящее перед формулой молекулы химического вещества, ко всем символам, и умножается на каждый каждого символа! Именно умножается, а не складывается! Это может показаться невероятным, но некоторые школьники складывают два числа вместо того, чтобы их перемножить.
Количество атомов каждого элемента исходных веществ (то есть находящихся в левой части уравнения) должно совпадать с количеством атомов каждого элемента продуктов реакции (соответственно, находящихся в его правой части).
Существует несколько методов определения коэффициентов в уравнениях окислительно-восстановительных реакций. Мы используем метод электронного баланса, при котором составление полного уравнения ОВР проводится в следующей последовательности:
1. Составляют схему реакции, указав вещества, вступившие в реакцию, и вещества, получившиеся в результате реакции, например:
2. Определяют степень окисления атомов и пишут ее знак и величину над символами элементов, отмечая элементы, степень окисления которых изменилась:
3. Записывают электронные уравнения реакций окисления и восстановления, определяют число электронов, отданных восстановителем и принятых окислителем, и затем уравнивают их, умножая на соответствующие коэффициенты:
4. Полученные коэффициенты, отвечающие электронному балансу, переносят в основное уравнение:
5.Уравнивают число атомов и ионов, не меняющих степени окисления (в последовательности: металлы, неметаллы, водород):
6.Проверяют правильность подбора коэффициентов по числу атомов кислорода в левой и правой части уравнения реакции – они должны быть равны (в этом уравнении 24 = 18 + 2 + 4, 24 = 24).
Рассмотрим более сложный пример:
Определим степени окисления атомов в молекулах:
Составим электронные уравнения реакций окисления и восстановления и уравняем число отданных и принятых электронов:
Перенесем коэффициенты в основное уравнение:
Уравняем число атомов, не меняющих степень окисления:
Подсчитав число атомов кислорода в правой и левой части уравнения, убедимся, что коэффициенты подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные свойства элементов зависят от строения электронной оболочки атомов и определяются их положением в периодической системе Менделеева.
Металлы, имея на внешнем энергетическом уровне 1-3 электрона, легко их отдают и проявляют только восстановительные свойства. Неметаллы (элементы IV-VII групп) могут как отдавать, так и принимать электроны, поэтому они могут проявлять и восстановительные и окислительные свойства. В периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются. В группах с повышением порядкового номера восстановительные свойства усиливаются, а окислительные ослабевают. Таким образом, из простых веществ лучшими восстановителями являются щелочные металлы, алюминий, водород, углерод; лучшими окислителями являются галогены и кислород .
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства
.
Важнейшими восстановителями являются
оксид углерода
 ,
сероводород
,
сероводород ,
сульфат железа(II)
,
сульфат железа(II)
 .Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
.Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства
.
Важнейшими окислителями являются
перманганат калия
 ,
дихромат калия
,
дихромат калия ,
пероксид водорода
,
пероксид водорода ,
азотная кислота
,
азотная кислота ,
концентрированная серная кислота
,
концентрированная серная кислота .
.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
 сернистая кислота проявляет
восстановительные свойства:
сернистая кислота проявляет
восстановительные свойства:
а при взаимодействии с сероводородом является окислителем:

Кроме того, для таких веществ возможны реакции самоокисления-самовосстановления, протекающие с одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
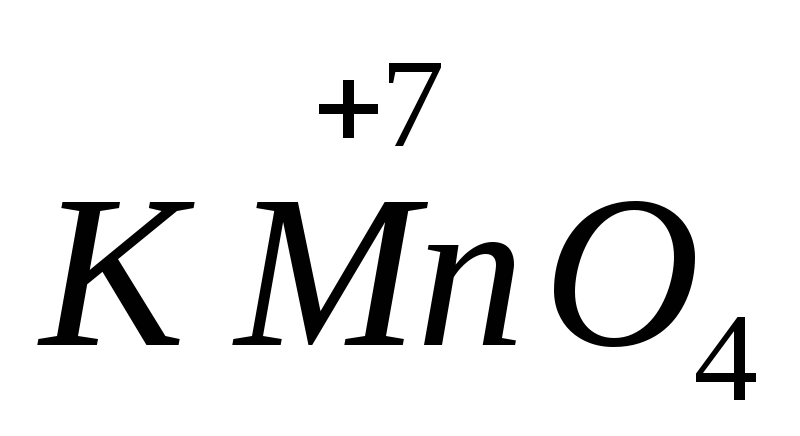 в щелочной среде восстанавливается до
в щелочной среде восстанавливается до ,
в нейтральной до
,
в нейтральной до ,
в присутствии серной кислоты - до
,
в присутствии серной кислоты - до .
.
Л егко ли расставлять коэффициенты в химических уравнениях?
егко ли расставлять коэффициенты в химических уравнениях?
Вот мои дети и доросли до химии (я классный руководитель в 8 «Б» классе). Химию чаще всего ребятам ставят на первом уроке , а в четверг у меня нет первого урока, и я попросился на урок к Валентине Ивановне «на детей посмотреть» и проверить дневники. Тема меня увлекла, в школе я любил химию, и дневники я не проверил. В очередной раз я убедился , что учащиеся чаще всего испытывают затруднения из-за того, что не видят межпредметных связей. На этом уроке химии учащиеся должны были составить химические уравнения, зная валентность химических веществ. И многие учащиеся испытали затруднения при определении числовых коэффициентов. Следующий урок химии в субботу мы с Валентиной Ивановной провели вместе.
Упражнение 1.
Запишите в виде химических уравнений следующие предложения:
А) «При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)»; б) «При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота».
Решение:
А) CaCO 3 = CaO + CO 2 - реакция эндотермическая. С этим заданием затруднений не оказалось, так как не нужно было подыскивать числовые коэффициенты. Изначально в левой и правой частях равенства по одному атому кальция по одному атому углерода и по три атома кислорода.
Б) P 2 O 5 + 3H 2 O = 2H 3 PO 4 - реакция экзотермическая. Со вторым уравнение возникли проблемы , без числовых коэффициентов не получилось верное равенство: P 2 O 5 + H 2 O → H 3 PO 4 . Очевидно , что для составления верного равенства нужно подбирать числовые коэффициенты. Если подбирать, то можно начать с фосфора: слева два атома, а справа – один, поэтому перед формулой азотной кислоты поставим числовой множитель, равный двум и тогда получим: P 2 O 5 + H 2 O → 2H 3 PO 4 . Но теперь осталось уравнять число атомов кислорода и водорода: водорода слева два атома , а справа - шесть атомов, поэтому перед формулой воды поставим числовой коэффициент, равный трём и тогда получим: P 2 O 5 + 3H 2 O → 2H 3 PO 4 . Теперь легко убедиться, что в каждой из частей уравнения равные количества и атомов фосфора и атомов водорода и атомов кислорода , следовательно, мы получили верное уравнение химической реакции: P 2 O 5 + 3H 2 O = 2H 3 PO 4 .
Второй способ: алгебраический. Предположим, что в уравнении поставили три коэффициента а, в, с , что получилось верное уравнение химической реакции: а P 2 O 5 + в H 2 O = с H 3 PO 4 . Так как в уравнении используются атомы трёх видов, то составим систему из трёх линейных уравнений с тремя неизвестными а, в и с .
Вещества, которые использовались в химической реакции: Р – фосфор; О 2 – кислород ; P 2 O 5 – оксид фосфора (V).
В) Fe 2 (SO 4) 3 + KOH → Fe(OH) 3 + K 2 SO 4 .
Вещества, которые использовались в химической реакции: Fe 2 (SO 4) 3 – сульфат железа (III); KOH – гидроксид калия; Fe(OH) 3 – гидроксид железа (III); K 2 SO 4 – сульфат калия.
Г) CuOH → Cu 2 O + H 2 O.
Решение:
2CuOH = Cu 2 O + H 2 O. Задачу по определению числовых коэффициентов решали , составляя систему уравнений: 
Вещества, которые использовались в химической реакции: CuOH – гидроксид меди (I); Cu 2 O – оксид меди (I); H 2 O – вода.
Д) CS 2 + O 2 → CO 2 + SO 2 .
Решение : CS 2 + 3O 2 = CO 2 + 2SO 2 . Решали подбором коэффициентов: уравняли число атомов серы (2); уравняли число атомов кислорода (3).
Вещества, которые использовались в химической реакции: CS 2 – сульфид серы (IV); O 2 –
Вещества, которые использовались в химической реакции: FeS 2 – колчедан; O 2 – кислород; Fe 2 O 3 – оксид железа (III); SO 2 - оксид серы (IV).
Упражнение 3.
(Было предложено для решения как самостоятельная работа).
Условие:
Запишите уравнения химических реакций по следующим схемам:
А) фосфорная кислота + гидроксид натрия → фосфат натрия + вода;
Б) оксид натрия + вода → гидроксид натрия;
В) оксид железа (II) + алюминий → оксид алюминия + железо;
Г) гидроксид меди (II)→ оксид меди (II) + вода.
Ответ:
А) 2H 3 PO 4 + 6NaOH = 2Na 3 PO 4 + 6H 2 O;
Б) Na 2 O + H 2 O = 2NaOH;
В) 3FeO + 2Al = Al 2 O 3 + 3Fe;
Г) Cu(OH) 2 = CuO + H 2 O.
За 10 минут 85% учащихся справились с заданием на «отлично», что приятно удивило Валентину Ивановну.