Мазок крови пациента с хроническим миелолейкозом
Хронический миелолейкоз (ХМЛ) — злокачественное новообразование кроветворной ткани, сопровождающееся прогрессирующей пролиферацией незрелых гранулоцитов. Заболевание изначально обладает вялотекущим характером, постепенно перетекая в стадию обострения с выраженной симптоматикой и образованием системных нарушений. Является одной из самых опасных и инвалидизирующих болезней.
ХМЛ — первое онкологическое заболевание, у которого определена связь между развитием канцерогенеза и мутацией в гене. Характерная аномалия основана на транслокации 9-й и 22-й хромосом, то есть участки данных хромосом меняются местами, образуя аберрантную хромосому. Выявлена мутировавшая хромосома исследователями из Филадельфии, поэтому она получила название филадельфийская или Ph-хромосома.
Изучение Ph-хромосомы и её влияния позволило разработать новое средство для подавления онкологических процессов, благодаря которому продолжительность жизни пациентов значительно увеличилась. Однако болезнь до сих пор остаётся неизлечимой. Число первичных ХМЛ диагностируется у 1,5:100 000 населения в год, пик заболеваемости приходится на возраст 30-50 лет, 30% ХМЛ выявляется у лиц старше 60 лет, у детей заболевание диагностируется менее чем в 5% случаев.
Причины развития

Негативное воздействие на кроветворение оказывают ядохимикаты
Заболевание известно науке с 1811 года, но до сих пор факторы, провоцирующие мутацию в гене, определить не удалось. Существует ряд причин, способствующих развитию патологии:
- радиоактивное облучение, в том числе при лучевой терапии;
- химиотерапия иных онкологических заболеваний;
- ряд генетических заболеваний, характеризующихся хромосомной аномалией (например, синдром Дауна);
- взаимодействие с химическими соединениями (нефтепродукты, пестициды).
Патогенез хронического миелолейкоза

Патогенез хронического миелолейкоза
Гибридный ген BCR-ABL 1, образованный в результате транслокации хромосом, продуцирует синтез белка BCR-ABL. Данный белок представляет собой тирозинкиназу, которая в норме способствует передаче сигнальных импульсов для роста клетки. Созданная путём мутации тирозинкиназа становится активным фактором пролиферации клеток, они начинают делиться и распространяться уже независимо от факторов роста. Происходит процесс создания клонов мутировавшей клетки.
Бесконтрольное деление сопровождается нарушением апоптоза — запрограммированной гибели клеток. Также гибридная тирозинкиназа подавляет естественные функции восстановления в молекулах ДНК, создавая предпосылки для последующих мутаций, что усугубляет патологический процесс.
Размножающиеся клетки являются незрелыми, бластными предшественниками полноценных элементов крови. Постепенно бластные клетки вытесняют функциональные эритроциты, тромбоциты и лейкоциты. Добавляются нарушения и в других хромосомах, что запускает ускоренный процесс разрушения организма в целом.
Стадии хронического миелолейкоза

Бластный криз — одна из стадий миелолейкоза
- Хроническая — < 15% бластных клеток. Обычно стадия длится несколько лет. Признаки заболевания нередко обнаруживаются лишь в результатах общего анализа крови. Выявляется ХМЛ на этой стадии более чем у 80% пациентов. Мутировавшая клетка ещё контролируется геном BCR-ABL, способность к дифференцировке сохранена, а здоровые клетки функционируют в естественном режиме.
- Прогрессирующая (акселерация) — 15 — 29 % бластных клеток. Ускоренный процесс распространения незрелых клеток сокращает медиану продолжительности жизни до года. Развивается тромбоцитопения, растёт число лейкоцитов, появляются признаки резистентности к терапии. На данной стадии патология выявляется у 10-12% больных. Опухолевые клетки начинают подавлять здоровые, теряют связь с микроокружением, активно перемещаются из костного мозга в кровеносное русло. Начинают зарождаться последующие мутации в хромосомах.
- Бластный криз — > 30% бластных клеток. Стадия характеризуется агрессивным характером мутировавших клеток, состояние пациента резко ухудшается. Дополнительные аномалии как в гене BCR-ABL, так и в геноме в целом, провоцируют цепь патологических реакций, которые уже практически не поддаются лечению. На этом этапе могут поражаться ткани внутренних органов, кожные покровы и слизистые оболочки, миелоидные клетки преобразовываются в саркому.
Симптомы и признаки

Геморрагический синдром
Признаки ХМЛ становятся заметны ближе к прогрессирующей стадии.
- Симптомы опухолевой интоксикации: снижение массы тела, быстрая утомляемость, волнообразное повышение температуры, кожный зуд, тошнота, суставные боли.
- Симптомы опухолевой пролиферации — увеличение селезёнки и печени, боль в левом подреберье, поражение кожных покровов.
- Анемический синдром — головокружение, выраженная бледность, учащённое сердцебиение, чувство нехватки воздуха.
- Геморрагический синдром — склонность к кровоточивости слизистых оболочек, сыпь в виде красных точек, длительное кровотечение при незначительных порезах.
Диагностика заболевания

Один из методов диагностики заболевания — рентгенологический
Диагностика ХМЛ включает:
- Первичный осмотр пациента с изучением анамнеза, жалоб, а также исследование при помощи пальпации размеров селезёнки и печени.
- Общий анализ крови выявляет число и характеристики форменных элементов крови.
- Биохимический анализ проводится для определения уровня билирубина, электролитов, глюкозы, ЛДГ, АСТ, АЛТ.
- Гистологическое исследование костного мозга определяет скопления бластных клеток.
- Цитогенетический анализ выявляет транслокацию хромосом.
- На 3-й стадии проводится иммунофенотипирование для идентификации бластных клеток.
- Метод генного секвенирования применяется для выявления генных мутаций.
- Проводится УЗИ внутренних органов, в первую очередь селезёнки и печени.
- Дополнительно назначают рентгенографию органов грудной клетки, ЭКГ, эхокардиографию, ИФА на маркеры различных заболеваний, коагулограмму и другие исследования.
Лечение

Основа лечения — ингибиторы тирозинкиназы
Терапия ХМЛ в настоящее время основана на применении ингибиторов тирозинкиназы. Средство I поколения иматиниб блокирует деятельность гибридной тирозинкиназы, проникая в «карман» белка BCR-ABL. Создание иматиниба совершило прорыв в лечении ХМЛ благодаря своей эффективности. Однако нередко у пациентов возникает устойчивость к препарату, что привело к созданию ингибиторов II поколения. Сочетание с другими методами лечения позволяет достичь высоких показателей в улучшении качества и продолжительности жизни.
Выбор препарата и доза определяются в зависимости от стадии ХМЛ и риска побочных эффектов. Обычно лечение начинается с приёма иматиниба в дозировке 400 мг/день при начальной стадии, 600 мг/день при последующих стадиях, затем дозу могут увеличивать или снижать. Различные аберрации в генах обусловливают низкую чувствительность к препаратам, поэтому пациенту могут менять одни ингибиторы на другие.

Трансплантация костного мозга
Терапия препаратами интерферона назначается обычно в 1-й стадии ХМЛ, так как не обладает эффективностью при последующих.
Для уменьшения массы опухоли и при отсутствии результата в лечении ингибиторами проводится химиотерапия. В стадии бластного криза используется полихимиотерапия аналогично лечению острого лейкоза.
Лучевая терапия может быть назначена в случае выраженной спленомегалии. При риске разрыва селезёнки проводят спленэктомию.
На сегодняшний день продолжаются исследования для создания ещё более совершенного препарата. Российскими учёными при помощи фонда «Сколково» проводятся клинические испытания ингибитора III поколения, который должен превзойти предыдущие по своей эффективности.
Профилактика и прогноз

Прогноз заболевания определяет врач
Причина образования ХМЛ не установлена, поэтому профилактикой являются меры по избеганию контактов с канцерогенными веществами, воздействия радиоактивного облучения.
Прогноз определяется стадией и тяжестью болезни. Одна из прогностических моделей (Kantarjian H.M.) включает факторы:
- преклонный возраст пациента при постановке диагноза;
- концентрация бластных клеток в крови ≥ 3%, в костном мозге ≥ 5%;
- концентрация базофилов ≥ 7%;
- концентрация тромбоцитов ≥ 700*10 9/л;
- выраженная спленомегалия.
Данная модель разработана для начальной фазы ХМЛ, если в наличии ≥ 3 признаков, прогноз неблагоприятный, последующие фазы рассматриваются как «всегда неблагоприятные». Однако каждый случай ХМЛ индивидуален, известны пациенты с продолжительностью жизни более 30 лет в хронической стадии. В среднем при своевременно начатом лечении ингибиторами тирозинкиназы 70-80% больных живут более 10 лет. При переходе болезни в прогрессирующую фазу выживаемость снижается в 3 — 4 раза, при бластном кризе по-прежнему составляет до 6 месяцев.
Хронический миелолейкоз - опухолевое заболевание крови. Характеризуется бесконтрольным ростом и размножением всех ростковых клеток крови, при этом молодые злокачественные клетки способны созревать до зрелых форм.
Хронический миелолейкоз (синоним – хронический миелоидный лейкоз) – опухолевое заболевание крови. Его развитие связано с изменениями в одной из хромосом и появлением химерного («сшитого» из разных фрагментов) гена, который нарушает кроветворение в красном костном мозге.
Во время хронического миелолейкоза в крови повышается содержание особой разновидности лейкоцитов – гранулоцитов . Они образуются в красном костном мозге в огромном количестве и выходят в кровь, не успевая до конца созреть. Одновременно содержание всех остальных видов лейкоцитов снижается.
Некоторые факты о распространенности хронического миелолейкоза :
- Каждое пятое опухолевое заболевание крови – это хронический миелолейкоз.
- Среди всех опухолей крови хронический миелолейкоз занимает в Северной Америке и Европе 3-е место, в Японии – 2-е место.
- Ежегодно во всем мире хронический миелолейкоз возникает у 1 из 100 000 человек.
- В течение последних 50 лет распространенность заболевания не изменилась.
- Чаще всего болезнь выявляется у людей в возрасте 30 – 40 лет.
- Мужчины и женщины заболевают примерно с одинаковой частотой.
Причины хронического миелолейкоза
Причины хромосомного нарушения, приводящего к хроническому миелолейкозу, до сих пор изучены недостаточно.Считается, что имеют значение следующие факторы:
 В результате поломок в хромосомах в клетках красного костного мозга появляется молекула ДНК с новой структурой. Образуется клон злокачественных клеток, которые постепенно вытесняют все остальные и занимают основную часть красного костного мозга. Порочный ген обеспечивает три основных эффекта:
В результате поломок в хромосомах в клетках красного костного мозга появляется молекула ДНК с новой структурой. Образуется клон злокачественных клеток, которые постепенно вытесняют все остальные и занимают основную часть красного костного мозга. Порочный ген обеспечивает три основных эффекта:
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
Фазы хронического миелолейкоза
- Хроническая фаза . В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации . Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза . Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Проявления хронического миелолейкоза
Симптомы хронической фазы:
 Более редкие симптомы хронической фазы миелолейкоза
:
Более редкие симптомы хронической фазы миелолейкоза
:- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец : различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови : нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
Симптомы фазы акселерации
В фазу акселерации признаки хронической стадии нарастают. Иногда именно в это время возникают первые признаки заболевания, которые и заставляют больного впервые посетить врача.Симптомы терминальной стадии хронического миелолейкоза:
- Резкая слабость , значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях . Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты .
- Периодическое беспричинное повышение температуры до 38 - 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела .
- Повышенная кровоточивость , появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки : живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Диагностика заболевания
К какому врачу следует обращаться при наличии симптомов хронического миелолейкоза?

Лечением заболеваний крови опухолевой природы занимается врач-гематолог. Многие пациенты изначально обращаются к терапевту, который затем отправляет на консультацию к гематологу.
Осмотр в кабинете врача
Прием в кабинете гематолога осуществляется следующим образом:- Расспрос пациента . Врач выясняет жалобы больного, уточняет время их возникновения, задает другие необходимые вопросы.
- Ощупывание лимфатических узлов : подчелюстных, шейных, подмышечных, надключичных и подключичных, локтевых, паховых, подколенных.
- Ощупывание живота для определения увеличения печени и селезенки. Печень ощупывают под правым ребром в положении лежа на спине. Селезенку – в левой части живота.
Когда врач может заподозрить у пациента хронический миелолейкоз?
Симптомы хронического миелолейкоза, особенно на начальных стадиях, неспецифичны – они могут встречаться при многих других заболеваниях. Поэтому врач не может предположить диагноз только на основании осмотра и жалоб пациента. Обычно подозрение возникает по данным одного из двух исследований:- Общий анализ крови . В нем обнаруживают повышенное количество лейкоцитов и большое количество их незрелых форм.
- УЗИ живота . Выявляется увеличение размеров селезенки.
Как производится полное обследование при подозрении на хронический миелолейкоз ?
| Название исследования | Описание | Что выявляет? |
| Общий анализ крови | Рутинное клиническое исследование, выполняется при подозрении на любые заболевания. Общий анализ крови помогает определить общее содержание лейкоцитов, их отдельных разновидностей, незрелых форм. Кровь для анализа берут из пальца или вены в утренние часы.
| Результат зависит от фазы заболевания. Хроническая фаза :
|
| Пункция и биопсия красного костного мозга | Красный костный мозг – главный кроветворный орган человека, который находится в костях. Во время исследования при помощи специальной иглы получают его небольшой фрагмент и направляют в лабораторию для исследования под микроскопом. Проведение процедуры :
| В красном костном мозге обнаруживается примерно та же картина, что и в общем анализе крови: резкое увеличение количества клеток-предшественниц, которые дают начало лейкоцитам.
|
| Цитохимическое исследование | При добавлении к образцам крови и красного костного мозга специальных красителей, с ними могут вступить в реакцию некоторые вещества. На этом основано проведение цитохимического исследования. Оно помогает установить активность определенных ферментов и служит для подтверждения диагноза хронического миелолейкоза, помогает отличить его от других видов лейкозов. | При хроническом миелоидном лейкозе цитохимическое исследование обнаруживает снижение в гранулоцитах активности особого фермента – щелочной фосфатазы
. |
| Биохимический анализ крови | При хроническом миелолейкозе изменяется содержание некоторых веществ в крови, что является косвенным диагностическим признаком. Забор крови для проведения анализа осуществляют из вены натощак, обычно в утренние часы.
| Вещества, содержание которых в крови повышено при хроническом миелолейкозе:
|
| Цитогенетическое исследование | Во время цитогенетического исследования изучают весь геном (набор хромосом и генов) человека. Для исследования используют кровь, которую берут из вены в пробирку и отправляют в лабораторию. Результат обычно бывает готов через 20 – 30 дней. В лаборатории используют специальные современные тесты, во время которых выявляют различные участки молекулы ДНК.
| При хроническом миелоидном лейкозе во время цитогенетического исследования выявляют хромосомное нарушение, которое было названо филадельфийской хромосомой
. В клетках пациентов происходит укорочение хромосомы №22. Утраченный участок присоединяется к хромосоме №9. В свою очередь, фрагмент хромосомы №9 присоединяется к хромосоме №22. Происходит как бы обмен, в результате которого гены начинают работать неправильно. В результате возникает миелолейкоз. Также выявляют и другие патологические изменения со стороны хромосомы №22. По их характеру можно частично судить о прогнозе заболевания. |
| УЗИ органов брюшной полости. | Ультразвуковое исследование применяется у пациентов с миелолейкозом для выявления увеличения печени и селезенки. УЗИ помогает отличить лейкоз от других заболеваний. | |
Лабораторные показатели
Общий анализ крови- Лейкоциты: значительно повышено от 30,0·10 9 /л до 300,0-500,0 ·10 9 /л
- Сдвиг лейкоцитарной формулы влево: преобладают молодые формы лейкоцитов (промиелоциты, миелоциты, метамиелоциты, бластные клетки)
- Базофилы: повышено количество 1% и более
- Эозинофилы: повышен уровень, более 5%
- Тромбоциты: в норме или повышен
- Щелочная фосфатаза лейкоцитов снижена или отсутствует.
- При генетическом анализе крови выявляется аномальная хромосома (филадельфийская хромосома).
Симптомы
Проявление симптомов зависит от фазы заболевания.I фаза (хроническая)
- Длительное время без симптомов (от 3 месяцев до 2 лет)
- Тяжесть в левом подреберье (из-за увеличения селезенки, чем выше уровень лейкоцитов, тем больше её размеры).
- Слабость
- Снижение работоспособности
- Потливость
- Потеря в весе
- инфаркт селезенки – острые боли в левом подреберье, температура 37,5 -38,5 °C, иногда тошнота и рвота, прикосновения к селезенке болезненны.
- Приапизм – болезненная, чрезмерно длительная эрекция.
Данные симптомы это предвестники тяжелого состояния (бластного криза), появляются за 6- 12 месяцев до его начала.
- Снижается эффективность лекарств (цитостатиков)
- Развивается анемия
- Увеличивается процент бластных клеток в крови
- Ухудшается общее состояние
- Увеличивается селезенка
- Симптомы соответствую клинической картине при остром лейкозе (см. Острый лимфолейоз ).
Как лечат миелолейкоз?
Цель лечения снизить рост опухолевых клеток и уменьшить размеры селезенки.Лечение заболевания должно быть начато сразу после того, как установлен диагноз. От качества и своевременности терапии во многом зависит прогноз.
Лечение включает различные методы: химиотерапия, лучевая терапия, удаление селезенки, пересадка костного мозга.
Лечение лекарствами
Химиотерапия- Классические препараты: Миелосан (Милеран, Бусульфан), Гидроксиуреа (Гидреа, Литалир), Цитозар, 6-меркаптопурни, альфа-интерферон.
- Новые препараты: Гливек, Спрайсел.
| Название | Описание |
Препараты гидроксимочевины
:
| Как действует препарат
: Гидроксимочевина – химическое соединение, способное подавлять синтез молекул ДНК в опухолевых клетках. Когда могут назначить : При хроническом миелолейкозе, сопровождающемся значительным повышением количества лейкоцитов в крови. Как назначают : Препарат выпускают в виде капсул. Врач назначает пациенту их прием в соответствии с выбранным режимом дозирования. Возможные побочные эффекты :
|
| Гливек (иматиниба мезилат) | Как действует препарат
: Препарат подавляет рост опухолевых клеток и усиливает процесс их естественной гибели. Когда могут назначать :
Препарат выпускается в виде таблеток. Схему применения и дозировки выбирает лечащий врач. Возможные побочные эффекты : Побочные эффекты препарата оценить сложно, так как пациенты, которые его принимают, обычно уже имеют выраженные нарушения о стороны разных органов. По статистике препарат приходится отменять из-за осложнений довольно редко:
|
| Интерферон-альфа | Как действует препарат
: Интерферон-альфа повышает иммунные силы организма и подавляет рост раковых клеток. Когда назначают : Обычно интерферон-альфа используют для длительной поддерживающей терапии после того, как количество лейкоцитов в крови нормализовалось. Как назначают : Препарат применяется в виде растворов для инъекций, вводится внутримышечно. Возможные побочные эффекты : Интерферон обладает достаточно большим количеством побочных эффектов, и с этим связаны определенные сложности в его применении. При правильном назначении препарата и постоянном контроле состояния пациента риск возникновения нежелательных эффектов можно свести к минимуму:
|
Пересадка костного мозга
 Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.
Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.Трансплантация красного костного мозга является наиболее эффективным методом лечения хронического миелоидного лейкоза. Более чем у половины пациентов, которым была произведена пересадка, наступает стойкое улучшение в течение 5 лет и дольше.
Чаще всего выздоровление происходит в том случае, когда красный костный мозг пересаживают больному моложе 50 лет в хроническую фазу заболевания.
Этапы трансплантации красного костного мозга :
- Поиск и подготовка донора . Лучшим донором стволовых клеток красного костного мозга является близкий родственник больного: близнец, брат, сестра. Если близких родственников нет, или они не подходят, ищут донора. Проводят ряд тестов для того, чтобы убедиться, что донорский материал приживется в теле пациента. Сегодня в развитых странах созданы большие банки доноров, в которых находятся десятки тысяч донорских образцов. Это дает шанс быстрее найти подходящие стволовые клетки.
- Подготовка пациента . Обычно этот этап продолжается от недели до 10 дней. Проводят лучевую терапию и химиотерапию для уничтожения как можно большего количества опухолевых клеток, предотвращения отторжения донорских клеток.
- Собственно пересадка красного костного мозга . Процедура похожа на переливание крови. В вену пациента заводят катетер, через который в кровь вводят стволовые клетки. Они какое-то время циркулируют в кровотоке, а потом оседают в костном мозге, приживаются там и начинают работать. Для предотвращения отторжения донорского материала врач назначает противовоспалительные и противоаллергические средства.
- Снижение иммунитета . Донорские клетки красного костного мозга не могут прижиться и начать функционировать сиюминутно. Для этого нужно время, обычно 2 – 4 недели. В течение этого срока у больного сильно снижен иммунитет. Его помещают в стационар, полностью ограждают от контакта с инфекциями, назначают антибиотики и противогрибковые средства. Этот период является одним из самых сложных. Сильно повышается температура тела, в организме могут активироваться хронические инфекции.
- Приживление донорских стволовых клеток . Самочувствие пациента начинает улучшаться.
- Восстановление . В течение нескольких месяцев или лет функция красного костного мозга продолжает восстанавливаться. Постепенно пациент выздоравливает, восстанавливается его работоспособность. Но он все еще должен находиться под наблюдением врача. Иногда новый иммунитет не может справиться с некоторыми инфекциями, в этом случае примерно через год после пересадки костного мозга делают прививки.
Лучевая терапия
 Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).
Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).В какой фазе заболевания применяется лучевая терапия?
Лучевая терапия используется в развернутой стадии хронического миелолейкоза, которая характеризуется признаками:
- Значительное разрастание опухолевой ткани в красном костном мозге.
- Рост опухолевых клеток в трубчатых костях 2 .
- Сильное увеличение печени и селезенки.
Применяется гамма-терапия – облучение области селезенки гамма-лучами. Основная задача – уничтожить или прекратить рост злокачественных опухолевых клеток. Лучевую дозу и режим облучения определяет лечащий врач.
Удаление селезенки (спленэктомия)
Удаление селезенки используется редко по ограниченным показаниям (инфаркт селезенки, тромбоцитопения, выраженный дискомфорт в животе).Операцию обычно проводят в терминальную фазу заболевания. Вместе с селезенкой из организма удаляют большое количество опухолевых клеток, тем самым облегчая течение заболевания. После операции обычно увеличивается эффективность медикаментозной терапии.
Каковы основные показания к операции?
- Разрыв селезенки.
- Угроза разрыва селезенки.
- Значительное увеличение органа в размерах, что приводит к сильному дискомфорту.
Очистка крови от избыточного количества лейкоцитов (лейкаферез)
При развитии бластного криза, лечение будет таким же, как при острых лейкозах (см. острый лимфолейкоз).
Лейкоцитаферез – лечебная процедура, напоминающая плазмаферез (очищение крови). У пациента берут определенное количество крови и пропускают через центрифугу, в которой она очищается от опухолевых клеток.
В какой фазе заболевания проводят лейкоцитаферез?
Так же, как и лучевую терапию, лейкоцитаферез проводят во время развернутой стадии миелолейкоза. Нередко его применяют в тех случаях, когда отсутствует эффект от применения лекарственных средств. Иногда лейкоцитаферез дополняет медикаментозную терапию.
Есть немало диагнозов, название которых обычным гражданам мало о чем говорит. Одним из таких заболеваний является хронический миелолейкоз. Отзывы больных этим недугом тем не менее способны привлечь внимание, поскольку данная болезнь может не только нанести значительный ущерб здоровью, но и привести к фатальному исходу.
Суть заболевания
Если приходится слышать такой диагноз, как "хронический миелолейкоз", то важно понимать, что речь идет о серьезном опухолевом заболевании системы кроветворения, при котором поражаются гемопоэтические стволовые клетки костного мозга. Его можно отнести к группе лейкозов, для которых характерны крупные образования гранулоцитов в крови.
В самом начале своего развития миелолейкоз проявляется посредством увеличения количества лейкоцитов, достигающего почти 20 000/мкл. При этом в прогрессирующей фазе данная цифра изменяется до 400 000/мкл. Стоит отметить и тот факт, что как в гемограмме, так и в миелограмме фиксируется преобладание клеток, имеющих различную степень зрелости. Речь идет о промиелоцитах, метамиелоцитах, палочкоядерных и миелоцитах. В случае развития миелолейкоза выявляются изменения в 21-й и 22-й хромосомах.
Данное заболевание в большинстве случаев приводит к ощутимому увеличению содержания базофилов и эозинофилов в крови. Этот факт является свидетельством того, что приходится иметь дело с тяжелой формой болезни. У больных, которые страдают таким онкологическим недугом, развивается спленомегалия, а в костном мозге и крови фиксируется большое количество миелобластов.
Как происходит зарождение болезни?
Хронический миелолейкоз патогенез имеет достаточно интересный. Изначально в качестве пускового фактора в развитии данного заболевания можно определить соматическую мутацию плюрипотентной гемопоэтической стволовой клетки крови. Основную роль в процессе мутации выполняет перекрестная транслокация хромосомного материала между 22-й и 9-й хромосомами. При этом происходит образование Ph-хромосомы.

Бывают случаи (не более 5 %), когда Ph-хромосому во время стандартного цитогенетического исследования обнаружить не удается. Хотя молекулярно-генетическое исследование выявляет онкоген.
Хронический миелолейкоз может развиватьсяи по причине воздействия различных химических соединений и радиации. Наиболее часто эта болезнь диагностируется в зрелом возрасте, крайне редко у подростков и детей. Что касается половой принадлежности, то данный вид опухоли с одинаковой частотой фиксируется как у мужчин, так и у женщин в возрасте от 40 до 70 лет.
Несмотря на весь опыт врачей, этиология развития миелолейкоза до сих пор остается не до конца ясной. Специалисты предполагают, что острый и хронический миелолейкоз развивается по причине нарушения хромосомного аппарата, которое, в свою очередь, вызвано влиянием мутагенов или наследственных факторов.
Говоря о воздействии химических мутагенов, стоит обратить внимание на тот факт, что было зафиксировано достаточно случаев, когда у людей, подвергавшихся воздействию бензола или употреблявших цитостатические препараты («Мустарген», «Имуран», «Саркозолин», «Лейкеран» и др.), развивался миелолейкоз.
Хронический миелолейкоз: стадии
При таком диагнозе, как "миелолейкоз", различают три этапа развития данного заболевания:
Начальная. Характеризуется увеличением селезенки и стабильным нагнетанием лейкоцитов в крови. Состояние пациента рассматривают в динамике, не применяя радикальных мер лечения. Болезнь, как правило, диагностируется уже на этапе тотальной генерализации опухоли в костном мозге. При этом в селезенке, а в некоторых случаях и в печени, наблюдается обширная пролиферация опухолевых клеток, которая свойственна развернутой стадии.

Развернутая. Клинические признаки на этой стадии начинают доминировать, и пациенту назначается лечение с использованием специфических препаратов. На данном этапе миелоидная ткань в костном мозге, печени и селезенке разрастается, жир в плоских костях фактически полностью вытесняется. Также наблюдается резкое преобладание гранулоцитарного ростка и трехростковая пролиферация. Стоит отметить, что в развернутой стадии лимфатические узлы крайне редко поражаются лейкозным процессом. В некоторых случаях возможно развитие миелофиброза в костном мозге. Есть вероятность развития пневмосклероза. Что касается инфильтрации печени опухолевыми клетками, то в большинстве случаев она выражена достаточно ярко.
Терминальная. На данном этапе развития болезни прогрессирует тромбоцитопения и анемия. Становятся очевидными проявления различных осложнений (инфекции, кровотечения и др.). Нередко наблюдается развитие второй опухоли из незрелых стволовых клеток.
На какую продолжительность жизни стоит рассчитывать?
Если говорить о людях, которым пришлось столкнуться с хроническим миелолейкозом, то стоит отметить, что современные методики лечения значительно повысили шансы таких больных на относительно долгую жизнь. Благодаря тому факту, что были произведены открытия в области патогенетических механизмов развития болезни, позволившие разработать препараты, способные воздействовать на мутировавший ген, при таком диагнозе, как хронический миелолейкоз, продолжительность жизни пациентов может составлять 30-40 лет с момента выявления заболевания. Но это возможно при условии, что опухоль была доброкачественной (медленное увеличение лимфоузлов).
В случае развития прогрессирующей или классической формы средний показатель составляет от 6 до 8 лет с момента, когда была диагностирована болезнь. Но в каждом индивидуальном случае на количество лет, которыми сможет насладиться больной, ощутимое влияние оказывают меры, которые были предприняты в процессе лечения, равно как и форма заболевания.
В среднем, по статистическим данным, в течение первых двух лет после выявления заболевания умирает до 10 % пациентов и 20 % - в последующие годы. Немало больных миелолейкозом уходят из жизни в течение 4 лет после того, как был поставлен диагноз.
Клиническая картина
Развитие такого заболевания, как хронический миелолейкоз, проходит постепенно. В первое время больной чувствует ухудшение общего состояния здоровья, быструю утомляемость, слабость, а в некоторых случаях умеренную боль в левом подреберье. После проведения исследования нередко фиксируется увеличение селезенки, а при анализе крови обнаруживается значительный нейтрофильный лейкоцитоз, отличающийся наличием сдвига в лейкоцитарной формуле влево по причине действия миелоцитов с повышенным содержанием базофилов, эозинофилов и тромбоцитов. Когда наступает время развернутой картины болезни, то у пациентов наблюдается потеря трудоспособности по причине нарушения сна, потливости, стабильного нарастания общей слабости, значительного повышения температуры, боли в области селезенки и в костях. Также происходит потеря массы и аппетита. На данном этапе болезни селезенка и печень значительно увеличиваются.

При этом хронический миелолейкоз, симптомы которого отличаются в зависимости от этапа развития болезни, уже в начальной стадии ведет к тому, что в костном мозге выявляется преобладание эозинофилов, зернистых лейкоцитов и базофилов. Такой рост происходит за счет уменьшения других лейкоцитов, нормобластов и эритроцитов. Если процесс течения болезни начинает обостряться, то количество незрелых миелобластов и гранулоцитов значительно возрастает, начинают появляться гемоцитобласты.
Бластный криз при хроническом миелолейкозе приводит к тотальной властной метаплазии. При этом наблюдается высокая лихорадка, во время которой отсутствуют признаки инфекции. Развивается геморрагический синдром (кишечные, маточные, слизистые кровотечения и др.), лейкемиды в коже, оссалгии, лимфатические узлы увеличиваются, фиксируется полная резистентность к цитостатической терапии и инфекционные осложнения.
Если на процесс течения болезни не удалось ощутимо повлиять (или такие попытки не были предприняты вовсе), то состояние больных будет прогрессивно ухудшаться, при этом появится тромбоцитопения (дают о себе знать явления геморрагического диатеза) и резкая анемия. По причине того, что размеры печени и селезенки быстро растут, заметно увеличивается объем живота, состояние диафрагмы становится высоким, органы брюшной полости сдавливаются, и, как следствие перечисленных факторов, начинает уменьшаться дыхательная экскурсия легких. Более того, изменяется положение сердца.
Когда хронический миелолейкозразвивается до такого уровня, на фоне ярко выраженной анемии появляется головокружение, одышка, сердцебиение и головная боль.
Моноцитарный криз при миелолейкозе
Касаясь темы моноцитарного криза, нужно отметить, что это достаточно редкое явление, в процессе которого появляются и разрастаются молодые, атипичные и зрелые моноциты в костном мозге и крови. По причине того, что костномозговые барьеры нарушены, на терминальной стадии заболевания в крови появляются осколки ядер мегакариоцитов. Одним из наиболее важных элементов терминальной стадии при моноцитарном кризе является угнетение нормального кроветворения (независимо от морфологической картины). Процесс болезни отягощается по причине развития тромбоцитопении, анемии и гранулоцитопении.
У некоторых больных может фиксироваться быстрое увеличение селезенки.
Диагностика
Факт прогрессирования такого заболевания, как хронический миелолейкоз, прогноз развития которого может быть достаточно нерадужным, определяется посредством целого комплекса клинических данных и конкретных изменений в процессе кроветворения. При этом в обязательном порядке учитываются гистологические исследования, гистограммы и миелограммы. Если клинико-гематологическая картина выглядит недостаточно ясной и данных для того, чтобы уверенно поставить диагноз, не хватает, то врачи делают акцент на обнаружении Ph-хромосомы в моноцитах, мегакариоцитах, эритроцитах и гранулоцитах костного мозга.

В некоторых случаях приходится дифференцировать хронический миелолейкоз. Диагностика, которую можно определить, как дифференциальную, ориентирована на выявление типичной картины болезни с гиперлейкоцитозом и спленомегалией. Если вариант нетипичный, то производится гистологическое исследование пунктата селезенки, а также изучение миелограммы.
Определенные сложности могут наблюдаться при поступлении пациентов в стационар в состоянии бластного криза, симптомы которого очень похожи на миелобластный лейкоз. В такой ситуации ощутимо помогают данные основательно собранного анамнеза, цитохимические и цитогенетические исследования. Нередко хронический миелолейкоз приходится дифференцировать с остеомиелофиброзом, при котором можно наблюдать интенсивную миелоидную метаплазию в лимфоузлах, селезенке, печени, а также значительную спленомегалию.
Бывают ситуации, и они нередки, когда помогает выявить хронический миелолейкоз анализ крови у пациентов, которые проходили обычное обследование (при отсутствии жалоб и бессимптомном течении болезни).

Диффузный миелосклероз можно исключить посредством рентгенологического исследования костей, выявляющего множественные участки склероза в плоских костях. Еще одно заболевание, которое пусть и редко, но все же приходится дифференцировать с миелолейкозом, - это геморрагическая тромбоцитемия. Её можно охарактеризовать лейкоцитозом со сдвигом влево и увеличением селезенки.
Лабораторные исследования при диагностике миелолейкоза
Для того чтобы точно определить состояние пациента при подозрении на хронический миелолейкоз, анализ крови может проводиться в нескольких направлениях:
Биохимический анализ крови. Его используют для того, чтобы выявить нарушения в работе печени и почек, которые являются следствием применения определенных цитостатических средств или были спровоцированы распространением лейкозных клеток.

- Клинический анализ крови (полный). Необходим для измерения уровня различных клеток: тромбоцитов, лейкоцитов и эритроцитов. У большинства пациентов, которым пришлось столкнуться с такой болезнью, как хронический миелолейкоз, анализ выявляет большое количество незрелых белых клеток. Иногда может наблюдаться низкое количество тромбоцитов или эритроцитов. Подобные результаты не являются основанием для определения лейкоза без дополнительного теста, который направлен на исследование костного мозга.
Исследование образцов костного мозга и крови под микроскопом, проводимое патологом. В этом случае изучается форма и размер клеток. Незрелые клетки идентифицируются как бласты или миелобласты. Также идет подсчет количества кроветворных клеток в костном мозге. К данному процессу применим термин «клеточность». У тех, кто болен хроническим миелолейкозом, костный мозг, как правило, гиперклеточный (большое скопление кроветворных клеток и высокое содержание злокачественных).
Лечение
При таком заболевании, как хронический миелолейкоз, лечение определяется в зависимости от стадии развития опухолевых клеток. Если речь идет о слабовыраженных клинико-гематологических проявлениях в хронической стадии болезни, то в качестве актуальных лечебных мероприятий стоит рассматривать полноценное питание, обогащенное витаминами, регулярное диспансерное наблюдение и общеукрепляющую терапию. На течение заболевания благоприятно может повлиять «Интерферон».

В случае развития лейкоцитоза врачи назначают «Миелосан» (2-4 мг/сутки). Если приходится иметь дело с более высоким лейкоцитозом, то доза «Миелосана» может подниматься до 6 и даже 8 мг/сут. Ожидать проявления цитопенического эффекта стоит не ранее 10 дней после первого приема препарата. Уменьшение размеров селезенки и цитопенический эффект происходит в среднем во время 3-6-й недели лечения, если общая доза препарата составляла от 200 до 300 мг. Дальнейшая терапия подразумевает прием один раз в неделю 2-4 мг «Миелосана», который на данном этапе оказывает поддерживающий эффект. Если о себе дают знать первые признаки обострения, проводится миелосанотерапия.
Возможно использование такой методики, как лучевая терапия, но только в том случае, когда в качестве основного клинического симптома определяется спленомегалия. Для лечения пациентов, чья болезнь находится в прогрессирующей стадии, актуальна поли- и монохимиотерапия. Если фиксируется значительный лейкоцитоз, при недостаточно эффективном воздействии «Миелосана» назначается «Миелобромол» (125-250 мг в день). При этом осуществляется строгий контроль показателей периферической крови.
В случае развития значительной спленомегалии назначается «Допан» (однократно 6-10 г/сутки). Препарат пациенты принимают один раз в течение 4-10 дней. Интервалы между приемами определяются в зависимости от степени и скорости уменьшения числа лейкоцитов, а также размеров селезенки. Как только снижение лейкоцитов достигает приемлемого уровня, использование «Допана» прекращается.

Если у больного развивается резистентность к «Допану», «Миелосану», лучевой терапии и «Миелобромолу», для лечения назначается «Гексафосфамид». В целях эффективного воздействия на течение заболевания в прогрессирующей стадии используются программы ЦВАМП и АВАМП.
Если развивается резистентность к цитостатической терапии при таком заболевании, как хронический миелолейкоз, лечение в стадии прогрессирования будет ориентировано на использование лейкоцитофареза в сочетании с конкретной схемой полихимиотерапии. В качестве срочных показаний к лейкоцитофарезу можно определить клинические признаки стаза в сосудах головного мозга (чувство тяжести в голове, снижение слуха, головные боли), которые обусловлены гипертромбоцитозом и гиперлейкоцитозом.
В случае выявления бластного криза актуальными можно считать различные программы химиотерапии, используемые при лейкозах. Показаниями к трансфузиям эритроцитарной массы, тромбоконцентрата и антибактериальной терапии служат инфекционные осложнения, развитие анемии и тромбоцитопенической геморрагии.
Касаясь хронической стадии заболевания, стоит отметить, что на данном этапе развития миелолейкоза достаточно эффективной является трансплантация костного мозга. Эта методика способна обеспечить развитие клинико-гематологической ремиссии в 70 % случаев.
Срочным показанием для применения спленэктомии при хроническом миелолейкозе является угроза разрыва или сам разрыв селезенки. К относительным показаниям можно причислить тяжелый абдоминальный дискомфорт.
Тем пациентам, у которых были выявлены экстрамедуллярные опухолевые образования, представляющие угрозу для жизни, показана лучевая терапия.
Хронический миелолейкоз: отзывы
По словам больных, подобный диагноз является слишком серьезным, чтобы его игнорировать. Изучая свидетельства различных пациентов, становится очевидной реальная возможность победить заболевание. Для этого нужно своевременно пройти диагностику и курс последующего лечения. Только при участии высококвалифицированных специалистов есть шанс победить хронический миелолейкоз с минимальными потерями для здоровья.
Хронический миелолейкоз
Хронический миелоидный лейкоз (ХМЛ) - медленно прогрессирующий тип лейкоза, характеризующийся неконтролируемым образованием клеток миелоидного ряда в костном мозге и выходом незрелых клеток в периферическую кровь.
Клетки, образующиеся при лейкозе, представляют собой аномальные незрелые формы. Продолжительность жизни этих незрелых клеток больше, чем зрелых лейкоцитов. По мере развития заболевания незрелые клетки накапливаются в костном мозге, вытесняя нормальные клетки кроветворения.
Причины ХМЛ
Возникновение ХМЛ почти всегда связано с мутацией гена в хромосоме, который называется Филадельфийской хромосомой. Эта мутация происходит постепенно в течение жизни. Она не передается от родителей к детям. В большинстве случаев причина мутации не известна. Исследования показывают, что на развитие ХМЛ влияет воздействие больших доз радиации, например, после ядерных аварий или атомных взрывов. Однако большинство больных ХМЛ не подвергались воздействию радиации.
Симптомы ХМЛ
Приведенные симптомы, кроме хронического миелолейкоза, могут быть вызваны другими, менее серьезными заболеваниями. Если вы испытываете любой из них, обратитесь за консультацией к врачу.
Слабость
Нехватка энергии
Усталость
Необъяснимая потеря веса
Ночные поты
Лихорадка
Боль или чувство полноты ниже ребер
Боль в костях
Боль в суставах
Уменьшение толерантности к физической нагрузке
Увеличение печени или селезенки
Беспричинные кровотечения или кровоподтеки.
Диагностика ХМЛ
Врач спросит о симптомах и истории болезни, а также выполнит медицинский осмотр. Врач может также проверить на наличие опухания печень, селезенку или лимфатические узлы в подмышечных впадинах, в паху или на шее. Вы можете быть направлены в онкологу - врачу, который специализируется на лечении рака.
Тесты могут включать:
Анализы крови - для проверки изменений в количестве или появлении различных типов клеток крови
Аспирация костного мозга - удаление образца жидкости костного мозга для проверки на наличие раковых клеток
Биопсия костного мозга - удаление образца жидкости костного мозга и небольшого образца кости для проверки на наличие раковых клеток
Осмотр образцов под микроскопом - исследование образцов крови, жидкости костного мозга, ткани лимфатических узлов или спинномозговой жидкости
Анализы костей, крови, костного мозга, ткани лимфатического узла или спинномозговой жидкости - чтобы классифицировать тип лейкемии и определить, есть ли лейкозные клетки в лимфатических узлах или спинномозговой жидкости
Цитогенетический анализ - тест, позволяющий найти определенные изменения в хромосомах (генетический материал) лимфоцитов. Используется, чтобы установить конкретный диагноз и разработать план лечения ХМЛ
Рентген грудной клетки - позволяет обнаружить признаки инфекции легких или рак груди
Компьютерная томография брюшной полости - вид рентгена, который использует компьютер, чтобы сделать снимки органов внутри тела
МРТ - тест, который использует магнитные волны, чтобы сделать снимки структуры внутри тела
УЗИ - обследование, которое использует звуковые волны для изучения внутренних органов.
Лечение ХМЛ
Методика лечения ХМЛ зависит от стадии заболевания и состояния здоровья пациента.
Лекарственная терапия хронического миелолейкоза
Разработаны лекарства, которые могут подавлять молекулы, провоцирующие развитие лейкемии и гена, связанного с ним. Эти препараты часто используют на ранних стадиях ХМЛ. Они являются лучшим вариантом лечения, чем химиотерапия и биологическая терапия. Для лечения хронического миелолейкоза применяются следующие лекарства:
Иматиниб (Гливек, Генфатиниб, Филахромин, Неопакс, Иматиниб и т.д.)
Дазатиниб (Спрайсел)
Нилотиниб (Тасигна).
Босутиниб (Bosutinibum).
Химиотерапия при хроническом миелолейкозе
Химиотерапия - использование лекарственных препаратов для уничтожения раковых клеток. Препараты для химиотерапии могут быть предоставлены в различных формах: таблетки, инъекции, введение через катетер. Лекарства поступают в кровоток и разносятся по всему телу, убивая главным образом раковые, а также некоторые здоровые клетки.
Биологическая терапия
Этот метод лечения ХМЛ все еще проходит испытания в клинических условиях. Лечение заключается в применении лекарств или веществ, которые используются для увеличения или восстановления естественной защиты организма от рака. Этот тип терапии также называется лечение с использованием модификаторов биологических реакций. Иногда используются очень специфические (моноклональные) антитела, разработанные для подавления лейкозных клеток. В настоящее время терапия с помощью моноклональных антител ограничена клиническими испытаниями и недоступна в России.
Химиотерапия с трансплантацией стволовых клеток
Химиотерапия с трансплантацией стволовых клеток для лечения ХМЛ все еще проходит клинические испытания. Проведение химиотерапии сопровождается трансплантацией стволовых клеток (незрелые клетки крови). Они заменят кроветворные клетки, разрушенные лечением рака. Стволовые клетки отбираются из крови или костного мозга донора, после чего вводятся в организм пациента.
Подсадка лимфоцитов
Лимфоциты - тип белых кровяных клеток. Лимфоциты от донора вводятся в организм пациента и раковые клетки не атакуют их.
Операция при хроническом миелолейкозе
Может быть проведена спленэктомия - операция по удалению селезенки. Она проводится, если селезенка увеличилась или появились другие осложнения.
ТРАНСПЛАНТАЦИЯ
Пересадка костного мозга
Из-за того, что химиотерапевтические препараты разрушают клетки костного мозга, пересадка является по-настоящему спасительным средством для пациента. Целью трансплантации костного мозга является внедрение в организм здоровых клеток костного мозга параллельно с лечением высокими дозами химиотерапевтических средств (тем самым повышается вероятность уничтожения раковых клеток и полного выздоровления).
Пересадка стволовых клеток
Стволовыми называют клетки, на ранних стадиях развития, еще не превратившиеся в лейкоциты, эритроциты или тромбоциты. Стволовые клетки в наши дни получают из периферической крови при помощи специального прибора, позволяющего рассортировать клетки разных типов. В таком приборе кровь центрифугируется с большой скоростью и разделяется на составные элементы. Процесс длится 3-4 часа.
Стволовые клетки отбираются и замораживаются до процедуры пересадки. Если трансплантация прошла успешно, стволовые клетки приживутся в организме реципиента, пройдут процесс созревания, и из них впоследствии образуются все виды клеток крови: лейкоциты, эритроциты и тромбоциты. Пересадка клеток от донора называется аллогенной трансплантацией, пересадка клеток самого пациента (как правило, стволовых) – аутологичной трансплантацией.
Аллогенная трансплантация (от совместимого донора)
При аллогенной трансплантации источником клеток костного мозга или стволовых клеток является донор, чьи клетки подобыли признаны подходящими для пересадки после анализа на тканевую совместимость. В некоторых случаях донором может стать родственник пациента, но в принципе можно использовать клетки постороннего человека, если они успешно прошли проверку на совместимость.
Перед процедурой трансплантации необходимо полностью уничтожить все злокачественные клетки в костном мозге пациента. Для этого назначаются цитотоксичные препараты в высоких дозах и радиотерапия (облучение всего организма). Затем трансплантат вводится в организм пациента через внутривенную инфузию.
Процесс приживания трансплантированных клеток занимает несколько недель. Все это время иммунная система пациента функционирует на крайне низком уровне, поэтому в этот период нужно тщательно оберегать больного от инфекций. По этой причине после процедуры пересадки пациент находится в изоляторе, пока в его анализе крови не будет отмечен рост числа лейкоцитов. Такой рост является симптомом восстановления иммунной системы, приживания трансплантата и возобновления процесса кроветворения.
В течение нескольких месяцев после процедуры пересадки важно оставаться под медицинским наблюдением, чтобы в случае необходимости вовремя распознать состояние, называемое «трансплантат против хозяина». Это состояние, при котором клетки пересаженного костного мозга атакуют ткани организма пациента. Оно может возникнуть в течение 6 месяцев после процедуры трансплантации. Реакция «трансплантат против хозяина» может сопровождаться симптомами различной степени тяжести - от легких (понос, сыпь) до тяжелых (печеночная недостаточность). Для лечения этого состояния назначаются соответствующие лекарства. Возникновение реакции "трансплантат против хозяина" не означает, что трансплантация прошла неудачно.
Аутологичная трансплантация
При этой процедуре донором стволовых клеток является сам пациент, находящийся в периоде ремиссии.
Кровь забирается из вены пациента на одной руке, проходит через прибор, отделяющий стволовые клетки, и возвращается в тело через вену другой руки.
Что такое рецидив при ХМЛ?
Слово рецидив используется, если была ремиссия. В отношении ХМЛ ремиссия может быть, во-первых, гематологической, то есть когда исчезают все внешние проявления заболевания (нормализация размеров печени и селезенки, исчезновение очагов поражения в органах), а также полная нормализация показателей периферической крови; во-вторых, цитогенетический, когда клетки с Филадельфийской хромосомой (Ph) уже не выявляются; и третий вариант, молекулярной, когда наиболее чувствительными молекулярно-генетическими методами (полимеразно-цепная реакция, ПЦР) продукт (транскрипт) патологического гена BCR-ABL не удается выявить. Существование молекулярной ремиссии спорно, так как возможность выявления транскрипта гена зависит от чувствительности используемого гена, качества реагентики и опыта сотрудников лаборатории. К тому же, чувствительность современных методик в целом ограничена. На сегодняшний день даже в наилучших лабораториях мира патологический транскрипт выявляется, если его количество больше, чем 1 на 100 000 транскрипта нормального контрольного гена. В вязи с этим слово молекулярная ремиссия в научной литературе заменена термином «негативность ПЦР».
Так как есть разные уровни ремиссии, то есть и разные уровни рецидива - гематологический (появление поражения разных органов, вновь ухудшение показателей клинического анализа крови), цитогенетический (появление Ph-позитивных клеток), молекулярный (вновь выявление транскрипта BCR-ABL).
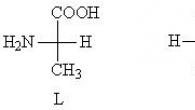
Аномальная Pb’-хромосома в клетке больного ХМЛ
Как можно обнаружить «рецидив ХМЛ»?
На сегодняшний день независимо от глубины достигнутой ремиссии, вплоть до молекулярной, рекомендуется постоянная непрерывная терапия ингибиторами тирозин киназ (ИТК). Перерывы в терапии или отмена препаратов показаны только из-за осложнений, связанных именно с ИТК. Естественно препараты также отменяют, если исходно не было эффекта или достигнутый эффект был позже утрачен.
На фоне терапии крайне важен мониторинг уровня лейкемических клеток с помощью не просто клинического анализа крови, но обязательно цитогенетического (особенно в течение первого года лечения) и ПЦР исследований. Именно молекулярно-генетические методики обнаруживают первые признаки рецидива болезни (появление лейкемических клеток) и свидетельствуют о возникшей неблагоприятной ситуации.
Почему возникает рецидив?
Причин множество и не все они изучены. Перечислю только наиболее яркие или изученные:
Как ни странно, нередкой причиной рецидива является неадекватный приём препарата пациентами. К сожалению, приходится сталкиваться с ситуацией, когда пациент самовольно снижает дозу препарата, вовсе перестаёт его принимать или принимает время от времени.
Одновременный длительный приём лекарств или веществ, снижающих концентрацию ИТК. Известно, что эти препараты разрушаются в печени под воздействием определенных ферментов - цитохромов. Есть большая группа лекарств или веществ, значительно повышающих активность этих цитохромов. В такой ситуации ИТК могут распадаться быстро, их концентрация резко снижается и, следовательно, снижается их эффективность. Поэтому, пациентов мы всегда предупреждаем о целесообразности сообщать нам, обо всех принимаемых препаратах. Мы не рекомендуем прием БАДов из-за невозможности оценить их влияние на концентрацию ИТК. К известным средствам, значительно активирующим цитохромы и снижающим активность ИТК относится, например, зверобой.
Эффективность ИТК также может снижаться из-за недостатка белков, которые «вкачивают» в клетку препараты или, наоборот, избытка белков, которые их «выкачивают» из клетки. Это может привести к снижению внутриклеточной концентрации ИТК.
Наиболее изученной причиной рецидивов следует считать появление мутаций (изменений) в гене BCR-ABL. Существует более 90 видов мутаций, которые могут менять структуру BCR-ABL белка. Не все они приводят к нарушению строения того участка белка, куда прикрепляются все ИТК. Поэтому, не все мутации одинаково плохо влияют на результаты лечения. К тому же для разных препаратов есть своя группа «плохих» мутаций. При этом есть одна мутация, появление которой приводит к неэффективности всех 3-х препаратов (иматиниб, нилотиниб, дазатиниб), зарегестрированных в России. Только ИТК под названием понатиниб (зарегистрирован в США в конце 2012 года) способен преодолеть те изменения, которые данная мутация привносит в клетку. Крайне важно выполнение мутационного анализа уже при появлении первых признаков неэффективности того или иного ИТК. Результаты данного анализа во многом помогают гематологу подобрать «правильный» ИТК для конкретного пациента.
Можно ли предотвратить рецидив?
Безусловно, можно, если причиной является неправильный приём препарата. Хотя не всегда удаётся исправить ситуацию впоследствии, но у части пациентов возобновление адекватной терапии приводит к улучшению ответа.
Риск рецидива также может быть снижен, если пациент не принимает препараты, влияющие на концентрацию ИТК.
Крайне важным является своевременное начало терапии ИТК сразу после постановки диагноза. Кроме того, в случае неэффективности первой линии ИТК, очень важна быстрая замена на другой ИТК. Всё это способствует быстрому снижению количества и активности лейкозных клеток. Это уменьшает риск развития в них дополнительных генетических изменений (мутации и др.), которые наиболее часто и приводят к рецидивам болезни даже после длительной ремиссии.
Учитывая все вышесказанное, наряду с соблюдением всех правил приёма препарата, крайне важно и своевременное обследование для оценки глубины ремиссии. Именно тщательный мониторинг (цитогенетический и/или ПЦР анализ) позволит врачу обнаружить рецидив болезни еще на ранних этапах и даст возможность своевременно назначить более эффективную терапию для повторного достижения ремиссии.
Хронический миелолейкоз в вопросах и ответах
Я заболел хмл. Что делать?
ХМЛ – хронический миелолейкоз, онкогематологическое заболевание крови, одна из разновидностей существующих лейкозов.
Хронический миелолейкоз – опухоль крови, не ограничивающая продолжительность жизни подавляющего большинства больных, благодаря современным препаратам и ответственному отношению к лечению.
Что делать? Довериться лечащему гематологу и соблюдать все рекомендации, а также своевременно проводить диагностические исследования.
Сколько я буду жить?
До недавнего времени средняя продолжительность жизни пациентов с ХМЛ составляла в среднем 3,5 года. Современные лекарственные средства позволяют продлить ее на срок более 20 лет, при этом качество жизни больных остается на высоком уровне и практически не отличается от жизни здорового человека.
Заразен ли хмл и передается ли он по наследству?
ХМЛ не является заразным заболеванием и не передается по наследству.
Может ли быть связан хмл с моей работой или экологией?
Влияние на заболеваемость ХМЛ таких факторов, как работа на вредном производстве, малые дозы радиации, слабое электромагнитное излучение, плохая экология мегаполисов и т.д., не нашли подтверждения. Поэтому не ищите причину, примите заболевание и научитесь с ним жить.
Почему лекарство нужно пить каждый день?
Лекарство необходимо принимать постоянно, пожизненно, без перерывов, т.к. в крови должна сохраняться определенная концентрация препарата. Самостоятельная отмена препарата может вызвать прогрессирование заболевания или препарат перестанет действовать на организм.
В какое время лучше принимать иматиниб?
Принимать препарат Иматиниб можно в удобное для вас время.
Последний прием Иматиниба должен быть не позднее, чем за 2 часа до сна.
Почему нельзя делать перерывы в приеме лекарства, когда перерывы необходимы?
Самостоятельная отмена препарата может вызвать потерю всех достигнутых результатов и привести к прогрессированию болезни (рецидиву). Перерывы в приеме препарата возможны только при наличии медицинских показаний и этот вопрос может решить только врач-гематолог.
Можно ли лечиться травами?
Не рекомендуется прием трав и БАДов из-за невозможности оценить их влияние на концентрацию препарата в крови. К известным средствам, значительно снижающим активность препарата, относятся, например, зверобой и женьшень.
Я слышал, что онкологию и хмл можно вылечить грибом чага или керосином?
К сожалению, вылечить народными средствами онкологию и ХМЛ невозможно.
Почему так часто необходимо сдавать анализы?
Анализы необходимы для контроля течения заболевания и своевременной корректировки лечения. Чтобы избежать повторного ухудшения самочувствия, каждое обследование необходимо проводить своевременно, когда назначил врач, и от этого зависит успех вашего лечения.
Почему недостаточно общего анализа крови?
Общий анализ крови - это забор крови из пальца или вены. Включает в себя подсчет лейкоцитов, эритроцитов, тромбоцитов и других компонентов крови, но этого анализа недостаточно, чтобы увидеть полную картину течения вашего заболевания.
Что такое цитогенетика? Обязательно ли ее сдавать?
Цитогенетический анализ – это забор костного мозга при стернальной пункции из грудины. При помощи этого исследования определяются хромосомные изменения и ответ на лечение, % клеток с филадельфийской хромосомой. Периодичность исследований определяет лечащий врач.
Что такое «молекулярная» диагностика?
Для проведения этого исследования сдают кровь из вены.
Молекулярный анализ является самым чувствительным методом диагностики ХМЛ из имеющихся.
Существует ли какая-то специальная диета при хмл?
Специальной диеты при заболевании ХМЛ не требуется.
Какие продукты нельзя принимать в пищу при хмл?
Можно ли пить витамины?
Необходимо быть крайне осторожными при ХМЛ с употреблением витаминов. Обязательно проконсультируйтесь с лечащим врачом.
Можно ли употреблять спиртное?
Не рекомендуется прием алкоголя, т.к. он может ускорять всасывание лекарств из пищеварительного тракта, создавая в организме более высокие концентрации препарата, чем при обычном приеме. Это приводит к передозировке или развитию токсических реакций, которые пагубно влияют на печень, как и сам алкоголь.
Можно ли мне работать?
В целом ХМЛ не влияет на вашу работоспособность, однако необходимо помнить о соблюдении режима лечения.
Можно ли мне заниматься спортом?
Посоветуйтесь со своим лечащим врачом.
Можно ли ходить в баню?
Можно ли отдыхать на море?
Отдыхать можно и нужно, с соблюдением простых правил:
Закрытая одежда и панамка;
Использование зонта (тента);
Не перегреваться.
Однако,
Можно ли загорать?
Не противопоказано пребывание на солнце до 11 утра и после 5 вечера с применением солнцезащитных кремов.
У меня сильная «побочка». Что делать?
Лечение ХМЛ часто сопровождается побочными эффектами, которые зависят от дозы препарата, фазы ХМЛ, длительности лечения, пола, возраста. Реакция разных людей на препараты индивидуальна, поэтому ваши побочные реакции могут отличаться от реакции других пациентов. При возникновении побочных эффектов, не прекращайте прием препарата, немедленно проконсультируйтесь со своим врачом, так как некоторые побочные эффекты требуют лечения.
Тошнота
Попробовать подобрать или исключить во время приема лекарства какие-то определенные продукты. Например, можно заесть зеленым яблоком. Исключить молочные, кислые и копченые продукты.
Изжога
Ограничить переедание, острые приправы, кофеин и алкоголь.
Не ложиться спать в течение 1-2 часов после приема иматиниба.
Задержка жидкости с развитием отеков
Ограничить прием соли в рационе, уменьшить объем употребляемой жидкости (особенно на ночь).
Косметические процедуры.
Необходима консультация у лечащего врача.
Диарея (понос)
Постарайтесь исключить такие продукты как чернослив, свекла, молочные и т.д.
Необходима консультация у лечащего врача.
Курага, фасоль, бобовые, крупы, мясо, морская капуста, свежие шампиньоны, картофель (особенно запеченный или сваренный в мундире), морковь, свекла, тыква, редька, перец, помидоры, огурцы, капуста, зелень (особенно шпинат и петрушка);
Яблоки, бананы, арбузы, дыни, киви, манго, авокадо, вишня, виноград, черная смородина, крыжовник, ежевика, сухофрукты (инжир, курага, чернослив, финики), орехи (особенно грецкие и фундук).
Кешью, гречневая крупа, гречиха, пшено, отруби, бобовые (особенно белая фасоль и соя), морковь, картофель, шпинат и другие листовые овощи абрикосы, персики, бананы, ежевика, малина, клубника, кунжут, орехи.
Кожные высыпания
Необходима консультация лечащего врача.
Повышение температуры, лихорадка
Такая реакция возможна на действие препарата.
Необходима консультация лечащего врача.
Я заболел (простудой, гриппом и т.д.). Что делать?
Не занимайтесь самолечением, проконсультируйтесь с лечащим врачом.
Мне назначены лекарственные препараты по сопутствующему заболеванию, можно ли их принимать вместе с иматинибом?
Проконсультируйтесь со специалистами.
В случае появления жалоб на фоне лечения необходимо обратиться к лечащему врачу для решения вопроса о необходимости корректировки терапии.
Нужна ли инвалидность для получения лекарственных препаратов?
Для получения лекарственных препаратов для лечения ХМЛ не требуется получение инвалидности.
Онкологическим больным все лекарственные средства положены бесплатно на основании действующего законодательства.
В каждом случае оформление инвалидности вопрос индивидуальный и вам самим необходимо определить для себя, нужна инвалидность или нет. А присвоят инвалидность или нет, будет зависеть от медицинских показаний.
Дают ли группу инвалидности при хмл?
Да, дают. Для получения группы инвалидности должны быть медицинские и социальные показания.
Критерии для МСЭ: Заболевание имеет неблагоприятный прогноз. Появление признаков акселерации, развитие бластного криза, свидетельствующие о тяжелых нарушениях функций и плохом прогнозе.
Критерии инвалидности.
III группа инвалидности определяется больным, у которых диагностирована хроническая фаза, при достижении клинико-гематологической ремиссии, адекватного снижения лейкоцитоза, при наличии ограничения способности к трудовой деятельности I ст., что требует рационального трудоустройства в не противопоказанных условиях и видах труда или уменьшения объема выполняемой работы.
II группа инвалидности определяется больным с прогрессированием заболевания, при отсутствии полной клинико-гематологической ремиссии и адекватного снижения лейкоцитоза; развитии осложнений, ограничении способности к самообслуживанию, передвижению и трудовой деятельности II ст.
I группа инвалидности определяется больным при наличии бластного криза, фазы акселерации, тяжелых гнойно-септических осложнений, ограничение способности к самообслуживанию и передвижению III ст. Больные нуждаются в постоянной посторонней помощи.
Мы хотим ребенка
Планирование беременности и для здоровых людей непростой вопрос, а для пациентов с ХМЛ этот вопрос требует ответственного решения. Но в любом случае, это решение должно приниматься только при участии лечащего врача, т.к. потребует корректировки лечения.
На сегодняшний день у пациентов с ХМЛ рождаются здоровые дети практически во всех регионах страны.
Что такое препараты 2-ой линии?
На сегодняшний день имеется ряд лекарственных препаратов, назначаемых пациентам, которым не помогает Иматиниб. Они гораздо сильнее по своему действию, но подбор для каждого пациента осуществляется индивидуально.
Как взаимодействует иматиниб с другими лекарственными препаратами?
При назначении лечения сопутствующих заболеваний другими специалистами необходимо заключение Вашего врача гематолога.
Необходимо обратить внимание:
Индукторы CYP3A4/5 - препараты, снижающие концентрацию ИТК в плазме:
Глюкокортикоиды, гризеофульвин, дексаметазон, дифенин, карбамазепин, окскарбазепин, прогестерон, рифабутин, рифампицин, сульфадимизин, троглитазон, фенилбутазон, фенобарбитал, этосуксимид.
Ингибиторы CYP3A4/5 - препараты, повышающие концентрацию ИТК в плазме:
Азитромицин, амиодарон, анастрозол, верапамил, гестоден, грейпфрутовый сок, даназол, дексаметазон, дилтиазем, диритромицин, дисульфирам, зафирлукаст, изониазид, итраконазол, метронидазол, мибефрадил, миконазол (средний), норфлоксацин, оксиконазол, омепразол (слабый), пароксетин (слабый), сертиндол, сертралин, флувоксамин, флуоксетин, хинидин, хинин, циклоспорин, кетоконазол, циметидин, кларитромицин, эритромицин, клотримазол, этинилэстрадиол
Препараты, удлиняющие интервал QT
- Антиаритмические: аденозин, амиодарон, флекаинид, хинидин, соталол.
- Противосудорожные: фелбамат, фенитоин.
- Антидепрессанты: амитриптилин, циталопрам, дезипрамин, доксепин, имипрамин, па роксетин, сертралин.
- Антигистаминные: астемизол, дифенгидрамин, лоратадин, терфенадин.
- Антигипертензивные: индапамид, мибефрадил, гидрохлортиазид, нифедипин.
- Противомикробные: макролиды, фторхинолоны.
- Противоопухолевые: триоксид мышьяка, тамоксифен.
- Нейролептики: хлорпромазин, клозапин, дроперидол, галоперидол, рисперидон.
- Препараты, действующие на желудочно-кишечный тракт: цизаприд, доласетрон, октреотид.
- Препараты разных групп: амантадин, метадон, салметерол, суматриптан, такролимус.