Металлической называется многоцентровая связь, которая существует в металлах и их сплавах между положительно заряженными ионами и валентными электронами, которые являются общими для всех ионов и свободно передвигаются по кристаллу.
Имеют небольшое количество валентных электронов и низкую ионизации. Эти электроны вследствие больших радиусов атомов металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них и становиться общими для всего кристалла металла. В результате в кристаллической решетке металла возникают положительно заряженные ионы металла и электронный газ — совокупность подвижных электронов, которые свободно передвигаются по кристаллу металла.
В результате металл представляет собой ряд положительных ионов, локализованных в определенных положениях , и большое количество электронов, которые сравнительно свободно передвигаются в поле положительных центров. Пространственное строение металлов — это кристалл, который можно представить как клетку с положительно заряженными ионами в узлах, погруженную в отрицательно заряженный электронный газ. Все атомы отдают свои валентные электроны на образование электронного газа, они свободно перемещаются внутри кристалла, не нарушая химической связи.
Теория о свободном перемещении электронов в кристаллической решетке металлов была экспериментально подтверждена опытом Толмена и Стюарта (в 1916г.): при резком торможении предварительно раскрученной катушки с намотанным проводом, свободные электроны продолжали некоторое время двигаться по инерции, и в это время амперметр, включенный в цепь катушки, регистрировал импульс электрического тока.
Разновидности моделей металлической связи
Признаками металлической связи являются такие характеристики:
- Многоэлектронность, поскольку в образовании металлического связи участвуют все валентные электроны;
- Многоцентровость, или делокализованность — связь соединяет одновременно большое количество атомов, содержащихся в кристалле металла;
- Изотропность, или ненаправленность — благодаря беспрепятственному передвижению электронного газа одновременно во все стороны металлическая связь является сферически симметричным.
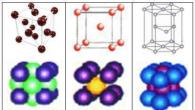
Металлические кристаллы образуют, в основном, три вида кристаллических решеток, однако некоторые металлы в зависимости от температуры могут иметь разные структуры.
 Кристаллические решетки металлов: а) кубическая гранецентрированная (Cu, Au, Ag, Al); б) кубическая объемноцентрированная (Li, Na, Ba, Mo, W, V); в) гексагональная (Mg, Zn, Ti, Cd, Cr)
Кристаллические решетки металлов: а) кубическая гранецентрированная (Cu, Au, Ag, Al); б) кубическая объемноцентрированная (Li, Na, Ba, Mo, W, V); в) гексагональная (Mg, Zn, Ti, Cd, Cr)
Металлическая связь существует в кристаллах и расплавах всех металлов и сплавов. В чистом виде она характерна для щелочных и щелочно-земельных металлов. У переходных d-металлов связь между атомами является частично ковалентной.
Химическая связь
Все взаимодействия, приводящие к объединению химических частиц (атомов, молекул, ионов и т. п.) в вещества делятся на химические связи и межмолекулярные связи (межмолекулярные взаимодействия).
Химические связи - связи непосредственно между атомами. Различают ионную, ковалентную и металлическую связь.
Межмолекулярные связи - связи между молекулами. Это водородная связь, ион-дипольная связь (за счет образования этой связи происходит, например, образование гидратной оболочки ионов), диполь-дипольная (за счет образования этой связи объединяются молекулы полярных веществ, например, в жидком ацетоне) и др.
Ионная связь
- химическая связь, образованная за счет электростатического притяжения разноименно заряженных ионов. В бинарных соединениях (соединениях двух элементов) она образуется в случае, когда размеры связываемых атомов сильно отличаются друг от друга: одни атомы большие, другие маленькие - то есть одни атомы легко отдают электроны, а другие склонны их принимать (обычно это атомы элементов, образующих типичные металлы и атомы элементов, образующих типичные неметаллы); электроотрицательность таких атомов также сильно отличается.
Ионная связь ненаправленная и не насыщаемая.
Ковалентная связь - химическая связь, возникающая за счет образования общей пары электронов. Ковалентная связь образуется между маленькими атомами с одинаковыми или близкими радиусами. Необходимое условие - наличие неспаренных электронов у обоих связываемых атомов (обменный механизм) или неподеленной пары у одного атома и свободной орбитали у другого (донорно-акцепторный механизм):
| а) | H· + ·H H:H | H-H | H 2 | (одна общая пара электронов; H одновалентен); |
| б) | NN | N 2 | (три общие пары электронов; N трехвалентен); | |
| в) | H-F | HF | (одна общая пара электронов; H и F одновалентны); | |
| г) | NH 4 + | (четыре общих пары электронов; N четырехвалентен) |
- По числу общих электронных пар ковалентные связи делятся на
- простые (одинарные) - одна пара электронов,
- двойные - две пары электронов,
- тройные - три пары электронов.
Двойные и тройные связи называются кратными связями.
По распределению электронной плотности между связываемыми атомами ковалентная связь делится на неполярную и полярную . Неполярная связь образуется между одинаковыми атомами, полярная - между разными.
Электроотрицательность
- мера способности атома в веществе притягивать к себе общие электронные пары.
Электронные пары полярных связей смещены в сторону более электроотрицательных элементов. Само смещение электронных пар называется поляризацией связи. Образующиеся при поляризации частичные (избыточные) заряды обозначаются + и -, например: .
По характеру перекрывания электронных облаков ("орбиталей") ковалентная связь делится на -связь и -связь.
-Связь образуется за счет прямого перекрывания электронных облаков (вдоль прямой, соединяющей ядра атомов), -связь - за счет бокового перекрывания (по обе стороны от плоскости, в которой лежат ядра атомов).
Ковалентная связь обладает направленностью и насыщаемостью, а также поляризуемостью.
Для объяснения и прогнозирования взаимного направления ковалентных связей используют модель гибридизации.
Гибридизация атомных орбиталей и электронных облаков
- предполагаемое выравнивание атомных орбиталей по энергии, а электронных облаков по форме при образовании атомом ковалентных связей.
Чаще всего встречается три типа гибридизации: sp
-, sp
2 и sp
3 -гибридизация. Например:
sp
-гибридизация - в молекулах C 2 H 2 , BeH 2 , CO 2 (линейное строение);
sp
2 -гибридизация - в молекулах C 2 H 4 , C 6 H 6 , BF 3 (плоская треугольная форма);
sp
3 -гибридизация - в молекулах CCl 4 , SiH 4 , CH 4 (тетраэдрическая форма); NH 3 (пирамидальная форма); H 2 O (уголковая форма).
Металлическая связь
- химическая связь, образованная за счет обобществления валентных электронов всех связываемых атомов металлического кристалла. В результате образуется единое электронное облако кристалла, которое легко смещается под действием электрического напряжения - отсюда высокая электропроводность металлов.
Металлическая связь образуется в том случае, когда связываемые атомы большие и потому склонны отдавать электроны. Простые вещества с металлической связью - металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества - интерметаллические соединения (AlCr 2 , Ca 2 Cu, Cu 5 Zn 8 и др.).
Металлическая связь не обладает направленностью насыщаемостью. Она сохраняется и в расплавах металлов.
Водородная связь - межмолекулярная связь, образованная за счет частичного акцептирования пары электронов высокоэлектроотрицательнного атома атомом водорода с большим положительным частичным зарядом. Образуется в тех случаях, когда в одной молекуле есть атом с неподеленной парой электронов и высокой электроотрицательностью (F, O, N), а в другой - атом водорода, связанный сильно полярной связью с одним из таких атомов. Примеры межмолекулярных водородных связей:
H—O—H ··· OH 2 , H—O—H ··· NH 3 , H—O—H ··· F—H, H—F ··· H—F.
Внутримолекулярные водородные связи существуют в молекулах полипептидов, нуклеиновых кислот, белков и др.
Мерой прочности любой связи является энергия связи.
Энергия связи
- энергия необходимая для разрыва данной химической связи в 1 моле вещества. Единица измерений - 1 кДж/моль.
Энергии ионной и ковалентной связи - одного порядка, энергия водородной связи - на порядок меньше.
Энергия ковалентной связи зависит от размеров связываемых атомов (длины связи) и от кратности связи. Чем меньше атомы и больше кратность связи, тем больше ее энергия.
Энергия ионной связи зависит от размеров ионов и от их зарядов. Чем меньше ионы и больше их заряд, тем больше энергия связи.
Строение вещества
По типу строения все вещества делятся на молекулярные и немолекулярные . Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H 2 , O 2 , N 2 , Cl 2 , Br 2 , S 8 , P 4 и другие простые вещества; CO 2 , SO 2 , N 2 O 5 , H 2 O, HCl, HF, NH 3 , CH 4 , C 2 H 5 OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO 2 , SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Следует отметить, что в ионных веществах, кристаллы которых состоят из сложных ионов, есть и ковалентные связи, например: (Na +) 2 (SO 4 2-), (K +) 3 (PO 4 3-), (NH 4 +)(NO 3-) и т. д. Ковалентными связями связаны атомы, из которых состоят сложные ионы.
Металлы (вещества с металлической связью) очень разнообразны по своим физическим свойствам. Среди них есть жидкость (Hg), очень мягкие (Na, K) и очень твердые металлы (W, Nb).
Характерными физическими свойствами металлов является их высокая электропроводность (в отличие от полупроводников, уменьшается с ростом температуры), высокая теплоемкость и пластичность (у чистых металлов).
В твердом состоянии почти все вещества состоят из кристаллов. По типу строения и типу химической связи кристаллы ("кристаллические решетки") делят на атомные (кристаллы немолекулярных веществ с ковалентной связью), ионные (кристаллы ионных веществ), молекулярные (кристаллы молекулярных веществ с ковалентной связью) и металлические (кристаллы веществ с металлической связью).
Задачи и тесты по теме "Тема 10. "Химическая связь. Строение вещества"."
- Типы химической связи - Строение вещества 8–9 класс
Уроков: 2 Заданий: 9 Тестов: 1
- Заданий: 9 Тестов: 1
Проработав эту тему, Вы должны усвоить следующие понятия: химическая связь, межмолекулярная связь, ионная связь, ковалентная связь, металлическая связь, водородная связь, простая связь, двойная связь, тройная связь, кратные связи, неполярная связь, полярная связь, электроотрицательность, поляризация связи, - и -связь, гибридизация атомных орбиталей, энергия связи.
Вы должны знать классификацию веществ по типу строения, по типу химической связи, зависимость свойств простых и сложных веществ от типа химической связи и типа "кристаллической решетки".
Вы должны уметь: определять тип химической связи в веществе, тип гибридизации, составлять схемы образования связей, пользоваться понятием электроотрицательность, рядом электроотрицательностей; знать как меняется электроотрицательность у химических элементов одного периода, и одной группы для определения полярности ковалентной связи.
Убедившись, что все необходимое усвоено, переходите к выполнению заданий. Желаем успехов.
Рекомендованная литература:
- О. С. Габриелян, Г. Г. Лысова. Химия 11 кл. М., Дрофа, 2002.
- Г. Е. Рудзитис, Ф. Г. Фельдман. Химия 11 кл. М., Просвещение, 2001.
Классификация материалов
В настоящее время все современные материалы принято соответствующим образом классифицировать.
Наибольшее значение в технике имеют классификации по функциональным и структурным признакам материалов.
Главным критерием классификации материалов по структурным признакам является агрегатное состояние, в зависимости от которого их подразделяют на следующие типы: твердые материалы, жидкости, газы, плазма.
Твердые материалы в свою очередь делят на кристаллические и некристаллические.
Кристаллические материалы можно разделить по типу связи между частицами: атомные (ковалентные), ионные, металлические, молекулярные (Рис.2.1.).
Типы связей между атомами (молекулами) в кристаллах
Атом состоит из положительно заряженного ядра и движущихся вокруг него электронов (отрицательно заряженных). Атом в стационарном состоянии электрически нейтрален. Различают внешние (валентные) электроны, связь которых с ядром незначительна и внутренние – прочно связанные с ядром.
Формирование кристаллической решетки происходит следующим образом. При переходе из жидкого в кристаллическое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают.
Связь между атомами осуществляется электростатическими силами, т.е. по природе связь едина – имеет электрическую природу, но проявляется по-разному в разных кристаллах. Различают следующие типы связей: ионную, ковалентную, полярную, металлическую.
Ковалентный вид связи
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H 2 , O 2 , N 2 , Cl 2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H 2 O, NF 3 , CO 2 .
Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером.
При этом типе связи осуществляется обобществление свободных валентных электронов соседних атомов. Стремясь приобрести устойчивую валентную оболочку, состоящую из 8 электронов, атомы объединяются в молекулы, образуя одну или несколько пар электронов, которые становятся общими для соединяющихся атомов, т.е. одновременно входят в состав электронных оболочек двух атомов.
Материалы с ковалентной связью очень хрупки, но имеют высокую твердость (алмаз). Это, как правило, диэлектрики или полупроводники (германий, кремни) т.к. электрические заряды связаны между собой, а свободные электроны отсутствуют.
Ковалентной связью соединены атомы в молекулах простых газов (Н 2 , Cl 2 и др.)
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.
 Кристаллы с ионной связью (NaCl)
Кристаллы с ионной связью (NaCl)
Ионная связь - это химическая связь, образованная за счет электростатического притяжения между катионами и анионами .
Образование таких кристаллов образуется переходом электронов атомов одного типа к атомам другого от Na к Cl. Атом, потерявший электрон, становится положительно заряженным ионом, присоединивший электрон – отрицательным ионом. Сближение ионов разных знаков происходит до тех пор пока силы отталкивания ядра и электронных оболочек не уравновесят силы притяжения. Ионную связь имеют большинство минеральных диэлектриков и некоторые органические материалы.(NaCl, CsCl, CaF2.)
Твердые тела с ионной связью в большинстве случаев механически прочны, температуростойчивы, но часто хрупки. Материалы с этим типом связи в качестве конструкционных не применяются
Металлический тип связи
В металлах связь между отдельными атомами образуется за счет взаимодействия положительно заряженных ядер и коллективизированных электронов, которые свободно движутся в межатомных пространствах. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Такая связь называется металлической.
Наличие свободных электронов приводит к высокой электропроводности и теплопроводности металла, а также является причиной блеска металлов. Ковкость металлов объясняется перемещением и скольжением отдельных слоев атомов.
Практически в любом материале имеет место не один, а несколько типов связей. Свойства же материалов определяются преобладающими видами химических связей атомов и молекул вещества материала.
Из атомно-кристаллических материалов, в структуре которых преобладают ковалентные связи , наибольшее значение в технике имеют полиморфные модификации углерода и полупроводниковые материалы на основе элементов IV группы периодической системы элементов. Типичными представителями первых являются алмаз и графит - наиболее распространенная в земной коре и устойчивая модификация углерода со слоистой структурой. Полупроводниковые кристаллические германий и кремний являются основными материалами полупроводниковой электроники.
Большой интерес представляют некоторые соединения с ковалентной связью, такие как Fe 3 C, SiO, AlN - эти соединения играют большую роль в технических сплавах.
В обширную совокупность ионно-кристаллических материалов, имеющих кристаллическую структуру с ионным типом связей, входят оксиды металлов (соединения металлов с кислородом), которые являются составляющими важнейших руд, технологических присадок при плавке металлов, а также химические соединения металлов и неметаллов (бором, углеродом, азотом), которые используются как компоненты сплавов.
Металлический тип связи характерен для более чем 80 элементов таблицы Менделеева.
К кристаллическим твердым телам можно отнести и материалы со структурой молекулярных кристаллов , которая характерна для многих полимерных материалов, молекулы которых состоят из большого числа повторяющихся звеньев. Это биополимеры - высокомолекулярные природные соединения и их производные (в том числе древесина); синтетические полимеры, получаемые из простых органических соединений, молекулы которых имеют неорганические главные цепи и не содержат органических боковых групп. К числу неорганических полимеров относят силикаты и вяжущие. Природные силикаты - класс важнейших породообразующих минералов, составляющих около 80% массы земной коры. К неорганическим вяжущим материалам относятся цемент, гипс, известь и др. Молекулярные кристаллы инертных газов - элементов VIII группы периодической системы - испаряются при низких температурах, не переходя в жидкое состояние. Они находят применение в криоэлектронике, занимающейся созданием электронных приборов на основе явлений, которые имеют место в твердых телах при криогенных температурах.

Рис. 1.2. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Второй класс материалов составляют некристаллические твердые материалы . Ихразделяют по признаку упорядоченности и стабильности структуры на аморфные, стеклообразные и нестеклообразныые в полуразупорядоченном состоянии.
Типичными представителями аморфных материалов являются аморфные полупроводники, аморфные металлы и сплавы.
В группу стеклообразных материалов входят: ряд органических полимеров (полиметилакрилат при температурах ниже 105 °С, поливинилхлорид -ниже 82 °С и другие); многие неорганические материалы - неорганическое стекло на основе оксидов кремния, бора, алюминия, фосфора и т. д.; многие материалы для каменного литья - базальты и диабазы со стеклообразной структурой, металлургические шлаки, природные карбонаты с островной и цепочечной структурой (доломит, мергель, мрамор и др).
В нестеклообразном полуразупорядоченном состоянии находятся студни (структурированные системы полимер - растворитель, образующиеся при затвердевании растворов полимеров или набухании твердых полимеров), многие синтетические полимеры в высокоэластическом состоянии, каучуки и резины, большинство материалов на основе биополимеров, в том числе текстильные и кожевенные материалы, а также органические вяжущие материалы - битумы, дегти, пеки и др.
По функциональному назначению технические материалы делят на следующие группы.
Конструкционные материалы - твердые материалы, предназначенные для изготовления изделий, подвергаемых механическому воздействию. Они должны обладать комплексом механических свойств, обеспечивающих требуемые работоспособность и ресурс изделий при воздействии рабочей среды, температуры и других факторов.
Рис. 1.1. Классификация твердых кристаллических материалов по структурному признаку
Одновременно к ним предъявляют технологические требования, определяющие наименьшую трудоемкость изготовления деталей и конструкций, и экономические, касающиеся стоимости и доступности материала, что очень важно в условиях массового производства. К конструкционным материалам можно отнести металлы, силикаты и керамику, полимеры, резину, древесину, многие композиционные материалы.
Электротехнические материалы характеризуются особыми электрическими и магнитными свойствами и предназначены для изготовления изделий, применяемых для производства, передачи, преобразования и потребления электроэнергии. К ним относятся магнитные материалы, проводники, полупроводники, а также диэлектрики в твердой жидкой и газообразной фазах.
Триботехнические материалы предназначены для применения в узлах трения с целью регулирования параметров трения и изнашивания для обеспечения заданных работоспособности и ресурса этих узлов. Основными видами таких материалов являются смазочные, антифрикционные и фрикционные. К первым относят смазки в твердой (графит, тальк, дисульфид молибдена и др., жидкой (смазочные масла) и газообразной фазах (воздух, пары углеводородов и другие газы). В совокупность антифрикционных материалов входят сплавы цветных металлов (баббиты, бронзы и др.), серый чугун, пластмассы (текстолит, материалы на основе фторопластов и др.), металлокерамические композиционные материалы (бронзографит, железографит и др.), некоторые виды древесины и древесно-слоистых пластиков, резины, многие композиты. Фрикционные материалы имеют большой коэффициент трения и высокое сопротивление изнашиванию. К ним относятся некоторые виды пластмасс, чугунов, металлокерамики и других композиционных материалов.
Инструментальные материалы отличаются высокими показателями твердости, износоустойчивости и прочности, они предназначены для изготовления режущего, мерительного, слесарно-монтажного и другого инструмента. Сюда относятся такие материалы, как инструментальная сталь и твердые сплавы, алмаз и некоторые виды керамических материалов, многие композиционные материалы.
Рабочие тела - газообразные и жидкие материалы, с помощью которых энергию преобразуют в механическую работу, холод, теплоту. Рабочими телами служат водяной пар в паровых машинах и турбинах; аммиак, углекислота, фреон и другие хладагенты в холодильных машинах; масла в гидроприводе; воздух в пневматических двигателях; газообразные продукты сгорания органического топлива в газовых турбинах, двигателях внутреннего сгорания.
Топливо - горючие материалы, основной частью которых является углерод, применяемые с целью получения при их сжигании тепловой энергии. По происхождению топливо делят на природное (нефть, уголь, природный газ, горючие сланцы, торф, древесина) и искусственное (кокс, моторные топлива, генераторные газы и др.); по типу машин, в которых оно сжигается, - на ракетное, моторное, ядерное, турбинное и т. д.
163120 0
Каждый атом обладает некоторым числом электронов.
Вступая в химические реакции, атомы отдают, приобретают, либо обобществляют электроны, достигая наиболее устойчивой электронной конфигурации. Наиболее устойчивой оказывается конфигурация с наиболее низкой энергией (как в атомах благородных газов). Эта закономерность называется "правилом октета" (рис. 1).
Рис. 1.
Это правило применимо ко всем типам связей . Электронные связи между атомами позволяют им формировать устойчивые структуры, от простейших кристаллов до сложных биомолекул, образующих, в конечном счете, живые системы. Они отличаются от кристаллов непрерывным обменом веществ. При этом многие химические реакции протекают по механизмам электронного переноса , которые играют важнейшую роль в энергетических процессах в организме.
Химическая связь - это сила, удерживающая вместе два или несколько атомов, ионов, молекул или любую их комбинацию .
Природа химической связи универсальна: это электростатическая сила притяжения между отрицательно заряженными электронами и положительно заряженными ядрами, определяемая конфигурацией электронов внешней оболочки атомов. Способность атома образовывать химические связи называется валентностью , или степенью окисления . С валентностью связано понятие о валентных электронах - электронах, образующих химические связи, то есть находящихся на наиболее высокоэнергетических орбиталях. Соответственно, внешнюю оболочку атома, содержащую эти орбитали, называют валентной оболочкой . В настоящее время недостаточно указать наличие химической связи, а необходимо уточнить ее тип: ионная, ковалентная, диполь-дипольная, металлическая.
Первый тип связи - ионная связь
В соответствии с электронной теорией валентности Льюиса и Косселя, атомы могут достичь устойчивой электронной конфигурации двумя способами: во-первых, теряя электроны, превращаясь в катионы , во-вторых, приобретая их, превращаясь в анионы . В результате электронного переноса благодаря электростатической силе притяжения между ионами с зарядами противоположного знака образуется химическая связь, названная Косселем «электровалентной » (теперь ее называют ионной ).
В этом случае анионы и катионы образуют устойчивую электронную конфигурацию с заполненной внешней электронной оболочкой. Типичные ионные связи образуются из катионов Т и II групп периодической системы и анионов неметаллических элементов VI и VII групп (16 и 17 подгрупп - соответственно, халькогенов и галогенов ). Связи у ионных соединений ненасыщенные и ненаправленные, поэтому возможность электростатического взаимодействия с другими ионами у них сохраняется. На рис. 2 и 3 показаны примеры ионных связей, соответствующих модели электронного переноса Косселя.
Рис. 2.
Рис. 3. Ионная связь в молекуле поваренной соли (NaCl)
Здесь уместно напомнить о некоторых свойствах, объясняющих поведение веществ в природе, в частности, рассмотреть представление о кислотах и основаниях .
Водные растворы всех этих веществ являются электролитами. Они по-разному изменяют окраску индикаторов . Механизм действия индикаторов был открыт Ф.В. Оствальдом. Он показал, что индикаторы представляют собой слабые кислоты или основания, окраска которых в недиссоциированном и диссоциированном состояниях различается.
Основания способны нейтрализовать кислоты. Не все основания растворимы в воде (например, нерастворимы некоторые органические соединения, не содержащие ‑ ОН-групп, в частности, триэтиламин N(С 2 Н 5) 3) ; растворимые основания называют щелочами .
Водные растворы кислот вступают в характерные реакции:
а) с оксидами металлов - с образованием соли и воды;
б) с металлами - с образованием соли и водорода;
в) с карбонатами - с образованием соли, СO 2 и Н 2 O .
Свойства кислот и оснований описывают несколько теорий. В соответствие с теорией С.А. Аррениуса, кислота представляет собой вещество, диссоциирующее с образованием ионов Н + , тогда как основание образует ионы ОН ‑ . Эта теория не учитывает существования органических оснований, не имеющих гидроксильных групп.
В соответствие с протонной теорией Бренстеда и Лоури, кислота представляет собой вещество, содержащее молекулы или ионы, отдающие протоны (доноры протонов), а основание - вещество, состоящее из молекул или ионов, принимающие протоны (акцепторы протонов). Отметим, что в водных растворах ионы водорода существуют в гидратированной форме, то есть в виде ионов гидроксония H 3 O + . Эта теория описывает реакции не только с водой и гидроксидными ионами, но и осуществляющиеся в отсутствие растворителя или с неводным растворителем.
Например, в реакции между аммиаком NH 3 (слабым основанием) и хлороводородом в газовой фазе образуется твердый хлорид аммония, причем в равновесной смеси двух веществ всегда присутствуют 4 частицы, две из которых - кислоты, а две другие - основания:
Эта равновесная смесь состоит из двух сопряженных пар кислот и оснований:
1) NH 4 + и NH 3
2) HCl и Сl ‑
Здесь в каждой сопряженной паре кислота и основание различаются на один протон. Каждая кислота имеет сопряженное с ней основание. Сильной кислоте соответствует слабое сопряженное основание, а слабой кислоте - сильное сопряженное основание.
Теория Бренстеда-Лоури позволяет объяснить уникальность роли воды для жизнедеятельности биосферы. Вода, в зависимости от взаимодействующего с ней вещества, может проявлять свойства или кислоты, или основания. Например, в реакциях с водными растворами уксусной кислоты вода является основанием, а с водными растворами аммиака - кислотой.
1) СН 3 СООН + Н 2 O ↔ Н 3 O + + СН 3 СОО ‑ . Здесь молекула уксусной кислоты донирует протон молекуле воды;
2) NH 3 + Н 2 O ↔ NH 4 + + ОН ‑ . Здесь молекула аммиака акцептирует протон от молекулы воды.
Таким образом, вода может образовывать две сопряженные пары:
1) Н 2 O (кислота) и ОН ‑ (сопряженное основание)
2) Н 3 О + (кислота) и Н 2 O (сопряженное основание).
В первом случае вода донирует протон, а во втором - акцептирует его.
Такое свойство называется амфипротонностью . Вещества, способные вступать в реакции в качестве и кислот, и оснований, называются амфотерными . В живой природе такие вещества встречаются часто. Например, аминокислоты способны образовывать соли и с кислотами, и с основаниями. Поэтому пептиды легко образуют координационные соединения с присутствующими ионами металлов.
Таким образом, характерное свойство ионной связи - полное перемещение нары связывающих электронов к одному из ядер. Это означает, что между ионами существует область, где электронная плотность почти нулевая.
Второй тип связи - ковалентная связь
Атомы могут образовывать устойчивые электронные конфигурации путем обобществления электронов.
Такая связь образуется, когда пара электронов обобществляется по одному от каждого атома. В таком случае обобществленные электроны связи распределены между атомами поровну. Примерами ковалентной связи можно назвать гомоядерные двухатомные молекулы Н 2 , N 2 , F 2 . Этот же тип связи имеется у аллотропов O 2 и озона O 3 и у многоатомной молекулы S 8 , а также у гетероядерных молекул хлороводорода НСl , углекислого газа СO 2 , метана СH 4 , этанола С 2 Н 5 ОН , гексафторида серы SF 6 , ацетилена С 2 Н 2 . У всех этих молекул электроны одинаково общие, а их связи насыщенные и направлены одинаково (рис. 4).
Для биологов важно, что у двойной и тройной связей ковалентные радиусы атомов по сравнению с одинарной связью уменьшены.
Рис. 4. Ковалентная связь в молекуле Сl 2 .
Ионный и ковалентный типы связей - это два предельных случая множества существующих типов химических связей, причем на практике большинство связей промежуточные.
Соединения двух элементов, расположенных в противоположных концах одного или разных периодов системы Менделеева, преимущественно образуют ионные связи. По мере сближения элементов в пределах периода ионный характер их соединений уменьшается, а ковалентный - увеличивается. Например, галогениды и оксиды элементов левой части периодической таблицы образуют преимущественно ионные связи (NaCl, AgBr, BaSO 4 , CaCO 3 , KNO 3 , CaO, NaOH ), а такие же соединения элементов правой части таблицы - ковалентные (Н 2 O, СO 2 , NH 3 , NO 2 , СН 4 , фенол C 6 H 5 OH , глюкоза С 6 H 12 О 6 , этанол С 2 Н 5 ОН ).
Ковалентная связь, в свою очередь, имеет еще одну модификацию.
У многоатомных ионов и в сложных биологических молекулах оба электрона могут происходить только из одного атома. Он называется донором электронной пары. Атом, обобществляющий с донором эту пару электронов, называется акцептором электронной пары. Такая разновидность ковалентной связи названа координационной (донорно-акцепторной , или дативной ) связью (рис. 5). Этот тип связи наиболее важен для биологии и медицины, поскольку химия наиболее важных для метаболизма d-элементов в значительной степени описывается координационными связями.
Pиc. 5.
Как правило, в комплексном соединении атом металла выступает акцептором электронной пары; наоборот, при ионных и ковалентных связях атом металла является донором электрона.
Суть ковалентной связи и ее разновидности - координационной связи - можно прояснить с помощью еще одной теории кислот и оснований, предложенной ГН. Льюисом. Он несколько расширил смысловое понятие терминов «кислота» и «основание» по теории Бренстеда-Лоури. Теория Льюиса объясняет природу образования комплексных ионов и участие веществ в реакциях нуклеофильного замещения, то есть в образовании КС.
Согласно Льюису, кислота - это вещество, способное образовывать ковалентную связь путем акцептирования электронной пары от основания. Льюисовым основанием названо вещество, обладающее неподеленной электронной парой, которое, донируя электроны, образует ковалентную связь с Льюисовой кислотой.
То есть теория Льюиса расширяет круг кислотно-основных реакций также на реакции, в которых протоны не участвуют вовсе. Причем сам протон, по этой теории, также является кислотой, поскольку способен акцептировать электронную пару.
Следовательно, согласно этой теории, катионы являются Льюисовыми кислотами, а анионы - Льюисовыми основаниями. Примером могут служить следующие реакции:
Выше отмечено, что подразделение веществ на ионные и ковалентные относительное, поскольку полного перехода электрона от атомов металла к акцепторным атомам в ковалентных молекулах не происходит. В соединениях с ионной связью каждый ион находится в электрическом поле ионов противоположного знака, поэтому они взаимно поляризуются, а их оболочки деформируются.
Поляризуемость определяется электронной структурой, зарядом и размерами иона; у анионов она выше, чем у катионов. Наибольшая поляризуемость среди катионов - у катионов большего заряда и меньшего размера, например, у Hg 2+ , Cd 2+ , Pb 2+ , Аl 3+ , Тl 3+ . Сильным поляризующим действием обладает Н + . Поскольку влияние поляризации ионов двустороннее, она значительно изменяет свойства образуемых ими соединений.
Третий тип связи - диполь-дипольная связь
Кроме перечисленных типов связи, различают еще диполь-дипольные межмолекулярные взаимодействия, называемые также вандерваалъсовыми .
Сила этих взаимодействий зависит от природы молекул.
Выделяют взаимодействия трех типов: постоянный диполь - постоянный диполь (диполь-дипольное притяжение); постоянный диполь - индуцированный диполь (индукционное притяжение); мгновенный диполь - индуцированный диполь (дисперсионное притяжение, или лондоновские силы; рис. 6).
Рис. 6.
Диполь-дипольным моментом обладают только молекулы с полярными ковалентными связями (HCl, NH 3 , SO 2 , Н 2 O, C 6 H 5 Cl ), причем сила связи составляет 1-2 дебая (1Д = 3,338 × 10 ‑30 кулон-метра - Кл × м).
В биохимии выделяют еще один тип связи - водородную связь, являющуюся предельным случаем диполь-дипольного притяжения. Эта связь образована притяжением между атомом водорода и электроотрицательным атомом небольшого размера, чаще всего - кислородом, фтором и азотом. С крупными атомами, обладающими аналогичной электроотрицательностью (например, с хлором и серой), водородная связь оказывается значительно более слабой. Атом водорода отличается одной существенной особенностью: при оттягивании связывающих электронов его ядро - протон - оголяется и перестает экранироваться электронами.
Поэтому атом превращается в крупный диполь.
Водородная связь, в отличие от вандерваальсовой, образуется не только при межмолекулярных взаимодействиях, но и внутри одной молекулы - внутримолекулярная водородная связь. Водородные связи играют в биохимии важную роль, например, для стабилизации структуры белков в виде а-спирали, или для образования двойной спирали ДНК (рис. 7).
Рис.7.
Водородная и вандерваальсовая связи значительно слабее, чем ионная, ковалентная и координационная. Энергия межмолекулярных связей указана в табл. 1.
Таблица 1. Энергия межмолекулярных сил
Примечание : Степень межмолекулярных взаимодействий отражают показатели энтальпии плавления и испарения (кипения). Ионным соединениям требуется для разделения ионов значительно больше энергии, чем для разделения молекул. Энтальпии плавления ионных соединений значительно выше, чем молекулярных соединений.
Четвертый тип связи - металлическая связь
Наконец, имеется еще один тип межмолекулярных связей - металлический : связь положительных ионов решетки металлов со свободными электронами. В биологических объектах этот тип связи не встречается.
Из краткого обзора типов связей выясняется одна деталь: важным параметром атома или иона металла - донора электронов, а также атома - акцептоpa электронов является его размер .
Не вдаваясь в детали, отметим, что ковалентные радиусы атомов, ионные радиусы металлов и вандерваальсовы радиусы взаимодействующих молекул увеличиваются по мере возрастания их порядкового номера в группах периодической системы. При этом значения радиусов ионов - наименьшие, а вандерваальсовых радиусов - наибольшие. Как правило, при движении вниз по группе радиусы всех элементов увеличиваются, причем как ковалентные, так и вандерваальсовы.
Наибольшее значение для биологов и медиков имеют координационные
(донорно-акцепторные
) связи, рассматриваемые координационной химией.
Медицинская бионеорганика. Г.К. Барашков
Как уже указывалось в п. 4.2.2.1, металлическая связь - электронная связь атомных ядер с минимальной локализацией обобществленных электронов как на отдельных (в отличие от ионной связи) ядрах, так и на отдельных (в отличие от ковалентной связи) связях. В результате это многоцентровая химическая связь с дефицитом электронов, в которой обобществленные электроны (в виде «электронного газа») обеспечивают связь с максимально возможным числом ядер (катионов), образующих структуру жидких или твердых металлических веществ. Поэтому металлическая связь в целом не- направлена и насыщена, ее следует рассматривать как предельный случай делокализации ковалентной связи. Напомним, что в чистых металлах металлическая связь представляется прежде всего гомоядер- ной , т.е. не может иметь ионной компоненты. В результате типичной картиной распределения электронной плотности в металлах являются сферически симметричные остовы (катионы) в равномерно распределенном электронном газе (рис. 5.10).
Следовательно, конечная структура соединений с преимущественно металлическим типом связи определяется прежде всего сте- рическим фактором и плотностью упаковки в кристаллической решетке этих катионов (высокие КЧ). Метод ВС не может интерпретировать металлические связи. Согласно ММО металлическая связь характеризуется дефицитом электронов по сравнению с ковалентной связью. Строгое приложение ММО к металлическим связям и соединениям приводит к зонной теории (электронная модель металла), согласно которой в атомах, входящих в кристаллическую решетку металла, существует взаимодействие почти свободных валентных электронов, находящихся на внешних электронных орбитах, с (электрическим) периодическим полем кристаллической решетки. В результате энергетические уровни электронов расщепляются и образуют более или менее широкую зону. В соответствии со статистикой Ферми наиболее высокая энергетическая зона заселяется свободными электронами вплоть до полного заполнения, в особенности, если энергетическим термам отдельного атома соответствуют два электрона с антипараллельными спинами. Однако она может быть заполнена частично, что обеспечивает для электронов возможность их перехода на более высокие энергетические уровни. Тогда
эта зона называется зоной проводимости. Существует несколько основных типов взаимного расположения энергетических зон, соответствующих изолятору, одновалентному металлу, двухвалентному металлу, полупроводнику с собственной проводимостью, полупроводнику «-типа и примесному полупроводнику/ьтипа. Соотношение энергетических зон определяет также тип проводимости твердого тела.
Однако эта теория не позволяет количественно охарактеризовать различные металлические соединения и не привела к решению проблемы происхождения реальных кристаллических структур металлических фаз. Специфика природы химической связи в гомоядерных металлах, металлических сплавах и интерметаллических гетеросоединениях рассмотрена Н.В. Агеевым }